Ацилфермент
Cтраница 4
Основное различие заключается в том, что наличие ацетамидной группы приводит к выигрышу в энтропии активации. Константы скорости деацилирования ацилферментов с а-ацетамидной группой характеризуются меньшей отрицательной энтропией активации на величину 10 - 12 кал-моль-1 - град 1, при этом стабилизация переходного состояния ацилферментов с а-ацетамидной группой имеет чисто энтропийную природу. Взаимодействие между ацетамидной труп - Л пой и активным центром ориентиру - Д ет и замораживает гидролизуе - мую сложноэфирную связь в по - 5 ложении, обеспечивающем реакци - онноспособное состояние активного центра. [47]
На стадии деацилирования промежуточных соединений зафиксировано не было, хотя существуют косвенные указания, свидетельствующие об образовании по крайней мере одного такого соединения. Если экспериментальные доказательства образования ацилфермента получены давно [8], то данные об образовании промежуточного тетраэдрического соединения являются сравнительно новыми. [48]
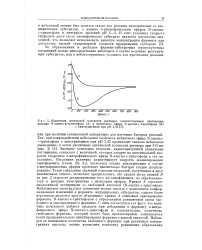 |
Изменение оптической плотности раствора, соответствующее протеканию реакции К-ацетил-ь - триптофана ( А и метилового эфира К-ацетил-ь - триптофана ( В. [49] |
Значение константы скорости, характеризующей увеличение поглощения, совпадает с величиной, которая следует из максимальной скорости гидролиза тг-нитрофенилового эфира М - ацетил-ь-триптофана в тех же условиях. Последняя величина характеризует скорость деацилирования ацилфермента [ схема ( 3), k3 ], поскольку стадия ацилирования в случае тг-нитрофениловых эфиров протекает значительно быстрее стадии деацилирования. Такое совпадение значений констант скоростей, полученных в двух независимых опытах, позволяет предположить, что правая ветвь кривой Б на рис. 2 отражает деацилирование того же ацилфермента, но образовавшегося в реакции химотрипсина с метиловым эфиром. Наблюдаемое спектральное изменение можно связать с появлением конфор-мационных изменений в ферменте, индуцируемых субстратом, однако более вероятным является другое объяснение: кривая А описывает ацилирование фермента N-ацетил-ь - триптофаном с образованием равновесной смеси свободного и ацилированного фермента. С этим согласуется тот факт, что величина начального выброса продукта при добавлении к ферменту тг-нитрофенилового эфира 1Ч - ацетил-ь-триптофана и, следовательно, количество свободного фермента, который может быть проацилирован, уменьшаются после предварительного инкубирования фермента с данной кислотой. [50]
В реакции полимерных или олигомерных субстратов, где наблюдается несколько разных по своей природе сорбционных эффектов, ускорение реакции за счет стабилизации ( концентрирования) переходного состояния может быть огромным, как, например, при гидролизе сложноэфирной связи в пептидных n - нитрофенилкарбоксилатах, катализируемом папаином. Ферментативный процесс идет через промежуточное образование ацилфермента, образующегося при ацилировании субстратом остатка Cys-25 ( см. схему на стр. [51]
Реакционная способность молекулы воды, принимающей участие в гидролизе специфического ацилфермента ( встроенной в активный центр N-ацетил - Ь - фенилаланилхимотрипсина), близка к реакционной способности гидроксильного иона. Поэтому можно заключить, что в ацилферменте, содержащем специфический субстратный остаток, протон молекулы воды, встроенной в активный центр, смещен в сторону имидазола His-57 практически нацело. [52]
Страницы: 1 2 3 4
