Ацилфермент
Cтраница 2
Фоточувствительную ферментативную систему можно получить, используя неактивный ацилфермент ( например, n - нитро - 1 с-цин-памоилхимотрипсин), который под действием света становится активным. Аналогично можно использовать неактивные субстраты, которые под действием света становятся активными. Примером такого субстрата является n - нитрофениловый эфир и-нитро - с-коричной кислоты, который под действием света изомеризуется в транс-форму, являющуюся активной. Кроме того, можно менять степень ингибирования фермента ( комплекс фермента с ингибитором), например, изменением рН среды, который, в свою очередь, изменяется под действием света. При помощи импульсного фотолиза можно создавать рН - екачок среды. [16]
Фоточувствительную ферментативную систему можно получить, используя неактивный ацилфермент ( например, я-н тро - ыс-циннамоилхимотрипсин), который под действием света становится активным. Аналогично можно использовать неактивные субстраты, которые под действием света становятся активными. Примером такого субстрата является / г-нитрофениловый эфир п-нитро-цис-корнчной кислоты, который под действием света изомеризуется в трансформу, являющуюся активной. Кроме того, можно менять степень ингибирова-ния фермента ( комплекс фермента с ингибитором), например изменением рН среды, который в свою очередь изменяется под действием света. [17]
В зависимости от строения ацильной части скорость гидролиза ацилферментов различается более чем в 104 раз, в то время как в реакции щелочного гидролиза эти различия весьма невелики. Структура активного центра фермента задает необходимые пространственные соотношения, определяющие реакционную способность ац илфермента. Было обнаружено, что в то время как ацилферментное промежуточное соединение, образуемое транс-стереоизомером кислоты, гидролизуется в течение минуты, ацил-фермент в г ис-стереоформе представляет собой практически стабильный, каталитически неактивный продукт. [18]
Таким образом, происходящая реакция сводится к образованию промежуточного ацилфермента, а затем к переносу ациль-ного остатка к молекуле воды, если протекает гидролиз, или к иному акцептору ацетильной группы. Серии, конечно, содержится в активном центре не всех ферментов. Так, например, у ри-бонуклеазы его нет, и в этом ферменте, как предполагается, два остатка гистидина выполняют функцию акцептора и донора протонов. Серии и гистидин, несомненно, являются не единственными остатками, необходимыми для работы активного центра. Имеются факты, говорящие об участии триптофана в активных центрах химотрипсина, трипсина, лизоцима, однако об этом пока еще известно мало. [19]
Характерной чертой рассматриваемого процесса является образование ковалентного интермедиата - ацилфермента. Ацилируемая каталитическая группа была идентифицирована - остаток Ser-195. Механизм катализа, осуществляемого ферментом, был предложен еще до установления пространственной структуры белка, но позднее был уточнен. [20]
В первом приближении это удовлетворительная модель для имитации образования промежуточного ацилфермента, хотя His-57 в а-химотрипсине действует как обшеосновной - общекислотный, а не нуклеофильный катализатор. [21]
Реакционная способность молекулы воды, принимающей участие в гидролизе специфического ацилфермента ( встроенной в активный центр N-ацетил - Ь - фенилаланилхимотрипсина), близка к реакционной способности гидроксильного иона. Поэтому можно заключить, что в ацилферменте, содержащем специфический субстратный остаток, протон молекулы воды, встроенной в активный центр, смещен в сторону имидазола His-57 практически нацело. [22]
В стационарном режиме ( dEA / dt Q) концентрация ацилфермента постоянна, последующий расход субстрата приводит к исчезновению в растворе промежуточных соединений. Аналогичная картина наблюдается при анализе других специфических слож-ноэфирных субстратов - метиловых эфиров N-ацетил - Ь - тирозина, N-аце-тил - Ь - триптофана, М - ацетил - Ь - лейци-на, N-ацетил - Ь - тирозина. Таким образом, полученные данные демонстрируют участие промежуточного ацилфермента в механизме гидролиза слож-ноэфирных субстратов а-химотрип-сина. [24]
 |
Скорости реакций сложных эфиров карбобензоксиглицина при 25. [25] |
Несмотря на то что ингибирование субстратом при связывании его с ацилферментом легко наблюдать кинетически, при малых глубинах ингибирования данный механизм можно и не обнаружить. Последнее может привести к различиям в кажущейся константе скорости реакции для разных субстратов. [26]
Равенство скоростей гидролиза различных производных объясняется тем, что для всех субстратов ацилфермент одинаков - во всех случаях это М - ацетил - Ь - триптофанилхимотрипсин. [27]
Если полагать, что катализируемый химотрипсином гидролиз амидов и анили-дов протекает через промежуточный ацилфермент, то образование промежуточного продукта, несомненно, лимитирует скорость реакции, поскольку ферментативный гидролиз сложных эфиров с той же ацильной группой идет значительно быстрее. Тот факт, что суммарная скорость реакции, измеряемая по выделению n - нитроанилина, почти не меняется в присутствии гидроксиламина ( даже в том случае, когда в присутствии 1 6 М гидроксиламина половину продукта составляет гидроксамовая кислота), действительно согласуется с представлением, что реакция протекает через общий промежуточный продукт-ацилфермент. К сожалению, в этих опытах не были порознь определены константы Михаэлиса и максимальные скорости реакции. В связи с этим очень вероятно, что высокая концентрация гидроксиламина, необходимая для образования заметных количеств гидроксамовой кислоты, неспецифически изменяет один или оба эти кинетических параметра и тем самым мешает обнаружить увеличение суммарной скорости реакции. Интерпретация результатов осложнена также тем, что фермент катализирует гидролиз образующейся гидроксамовой кислоты N-ацетилтирозина. [28]
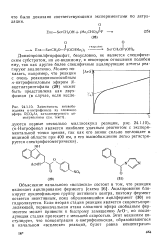 |
Зависимость высвобождения n - питрофенола из сложного эфира RCC Ar, катализируемого хи-мотрипсином ( текст. [29] |
Ацилирование блокирует нуклеофильную группу активного центра, поэтому фермент остается неактивным, пока образовавшийся ацилфермент ( 30) не гидролизуется. Если вторая стадия реакции является скоростьолре-деляющей, первоначальная атака сложного эфира свободным ферментом может привести к быстрому замещению АгО -, но последующая стадия протекает с меньшей скоростью. Этот механизм постулирует, что концентрация п-ни. [30]
Страницы: 1 2 3 4
