Достижение - эквивалентная точка
Cтраница 2
Вблизи или сразу после достижения эквивалентной точки по сероводороду частицы сернистого серебра быстро укрупняется, раствор делается - ярозрачным. [16]
Вблизи или сразу после достижения эквивалентной точки по сероводороду частицы сернистого серебра быстро укрупняются, раствор делается прозрачным. [17]
Спуск рабочего раствора ведут до достижения эквивалентной точки. В первых опытах учащиеся обычно ведут титрование очень долго, спуская по две-три капли. Чтобы ускорить работу, следует при первом титровании спускать по 1 - 2 мл и установить приблизительный расход рабочего раствора, а затем уже вести точное титрование, спуская большую часть раствора в один прием и доводя затем до эквивалентной точки по одной капле. Точное титрование повторяют трижды и берут среднее из трех определений. Спуски не должны различаться более чем на 0 1 мл. [18]
Для того чтобы можно было заметить достижение эквивалентной точки, в раствор прибавляют вспомогательный реактив, называемый индикатором. Когда реакция между титрованным раствором реактива и титруемым веществом дойдет до конца, индикатор в растворе претерпевает видимые изменения. Момент этот называется точкой конца титрования. [19]
Необходимо учитывать, что слабая красноватая окраска возникает раньше достижения эквивалентной точки и обусловлена некоторой растворимостью получающегося соединения. [20]
Электропроводность сначала уменьшается за счет уменьшения количества ионов, а после достижения эквивалентной точки вновь возрастает вследствие постепенного повышения содержания свободной гидроокиси бария. [21]
При кондуктометрическом анализе титрованный раствор подбирают таким образ-ом, чтобы после достижения эквивалентной точки и появления в растворе избытка реагента ход изменения электропроводности раствора менялся по возможности наиболее резко. [22]
При кондуктометрическом анализе титрованный раствор подбирают таким образом, чтобы после достижения эквивалентной точки и появления в растворе избытка реагента ход изменения электропроводности раствора менялся по возможности наиболее резко. [23]
В химический стакан с титруемым раствором добавляется реагент малыми порциями до достижения эквивалентной точки титрования, отмечаемой по прибору. Отсчет производится на бюретке. Индикатором при титровании ионов какого-либо вида может служить любой электрод, реагирующий на изменение концентрации определяемого иона в растворе. [24]
При титровании слабой ( почти не диссоциирующей) кислоты сильным основанием до достижения эквивалентной точки происходит увеличение электропроводности раствора, обусловленное образованием нацело диссоциирующей соли. После эквивалентной точки рост электропроводности происходит за счет появления избытка щелочи. [25]
Количество определяемого вещества вычисляют ро объемл стандартного раствора реактива, израсходованного до достижения эквивалентной точки. [26]
Титрование производят с тем индикатором, у которого интервал перехода соответствует рН раствора в момент достижения эквивалентной точки. [27]
В целом, наблюдаемый ход кривой кондуктометрического титрования отвечает до эквивалентной точки-солевой, а по достижении эквивалентной точки - щелочной прямой. Эквивалентная точка хорошо выявляется пересечением солевой и щелочной прямых. [28]
При недостатке окиси цинка образуется свободная кислота, окисление прекращается и раствор принимает фиолетовую окраску до достижения эквивалентной точки. [29]
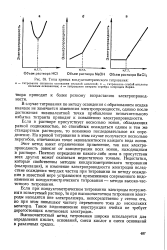 |
Типы кривых кондуктометрического титрования. [30] |
Страницы: 1 2 3 4