Молекулярная масса - белок
Cтраница 3
Установление первичной структуры начинается с определения аминокислотного состава и молекулярной массы выделенного и очищенного белка. Белки, состоящие из нескольких полипептидных цепей, разделяются с помощью денатурирующих реагентов ( концентрированный раствор мочевины или ДСН) на мономеры. Дисульфидные мостики расщепляют восстановлением меркаптоэтанолом. Для предотвращения дисульфидного обмена и окисления образующихся свободных меркаптогрупп их блокируют каким-либо методом, например алкилированием иодуксусной кислотой с образованием S-карбоксиметильного производного или цианэтилированием акри-лонитрилом. После определения N - и С-концевых аминокислот полипептидная цепь расщепляется химически или ферментативно ( в нескольких вариантах) на меньшие перекрывающиеся фрагменты. Для каждого фрагмента устанавливается аминокислотная последовательность. И наконец, комбинируя отдельные последовательности, приходят к полной последовательности исходной полипептидной цепи. [31]
Молекулы белка содержат от ста до нескольких тысяч аминокислотных остатков; молекулярная масса белка колеблется от десяти тысяч до нескольких миллионов. [32]
Обе константы не зависят от геометрии колонки и могут использоваться для оценки молекулярной массы белков. [33]
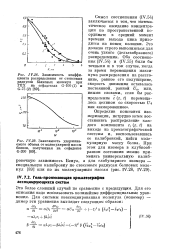
При определении молекулярной массы неизвестного соединения ( по методу, пригодному для определения молекулярной массы белков) лучше всего тщательно измерить расстояние от центра пятна этого соединения до стартовой линии и от центра пятна известного соединения, используемого как стандарт, до стартовой линии. Далее молекулярную массу определяют по кривой зависимости величин RM, рассчитанных по этой формуле, от молекулярной массы. [34]
Зная константы ассоциации и количественный состав белковой смеси из хроматографического эксперимента нетрудно найти молекулярную массу белка, используя одну из ранее упоминавшихся калибровочных зависимостей. [35]
Нуклеиновые кислоты - высокомолекулярные вещества, молекулярная масса которых не меньше, а скорее превышает молекулярную массу белков и исчисляется сотнями тысяч и миллионами. Высокомолекулярный характер, лабильность и большая сложность строения создавали и создают огромные трудности при изучении нуклеиновых кислот и строение их до сих пор не выяснено. В последние годы, однако, в этом направлении достигнуты довольно существенные успехи: выяснен общий тип строения нуклеиновых кислот, расшифровано строение одного простейшего представителя. [36]
От чего зависит скорость седиментации белков: а) от числа растворенных молекул; б) от молекулярной массы белка; в) от плотности растворителя разделяемых белков. [37]
От чего зависит осмотическое давление белковых растворов: а) от числа растворенных молекул; б) от молекулярной массы белка; в) от формы белковой молекулы. [38]
Для некоторых белков характеристическая вязкость раствора равна примерно 0 03 дл / г и в пределах ошибки эксперимента не зависит от молекулярной массы белка. [39]
Для некоторых фибриллярных белков [ г ] раствора равна 0 03 дл / г и в пределах ошибки опыта не зависит от молекулярной массы белка. Какова конформация макромолекул этих белков. [40]
Определив константы изомеризации, нетрудно затем восстановить распределение каждого компонента ct - ( x, t) на выходе из хроматографической системы и, воспользовавшись ее калибровкой, найти молекулярную массу белка. [42]
Последнее оказалось необходимым из-за того, что сефакрилъз S-500 и S-1000, предназначенные для фракционирования нуклеиновых кислот и полисахаридов, имеют столь крупные поры, что прокалибровать их по молекулярным массам белков не представляется возможным. [43]
Авторы обнаружили, что объем элюции для каждого белка увеличивается с ростом концентрации элюирующего фосфатного буфера ( от 0 02 до 0 2 М) и тем сильнее, чем меньше молекулярная масса белка. Одновременно пики расширяются, а при концентрации буфера 0 5 М не разрешаются вовсе. [44]
Для построения калибровочной кривой при определении молекулярных масс используют белки-стандарты: тропонин С ( 18000 Да), тропонин I ( 24000 Да), тропонин Т ( 38000 Да), яичный альбумин ( 42000 Да) и бычий сывороточный альбумин ( 68000 Да), а также стандартный набор для определения молекулярной массы белков. [45]
Страницы: 1 2 3 4