Атомные массы - элемент
Cтраница 1
Атомные массы элементов, рассчитанные с учетом нового стандарта, почти точно совпадают со старыми химическими атомными весами, и, кроме того, новый стандарт связан только с одним изотопом, а не плеядой изотопов. [1]
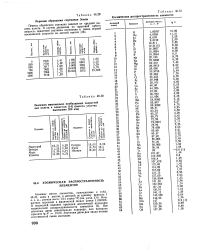 |
Периоды обращения спутников Земли.| Космическая распространенность элементов. [2] |
Атомные массы элементов, приведенные в табл. 46.31, даны в шкале, в которой за единицу принята 1 а. Значения даны для числа атомов естественной смеси изотопов. [3]
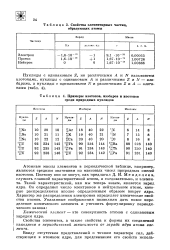 |
Свойства элементарных частиц, образующих атомы.| Примеры изотопов, изобаров и изотонов среди природных нуклидов. [4] |
Атомные массы элементов в периодической таблице, например, являются средним значением из массовых чисел природных смесей изотопов. Поэтому они не могут, как предлагал Д. И. Менделеев, служить главной характеристикой атома, а следовательно, и элемента. Такой характеристикой, как мы теперь знаем, является заряд ядра. Он определяет число электронов в нейтральном атоме, которые распределяются вполне определенным образом вокруг ядра. Характер же распределения электронов определяет химические свойства атомов. [5]
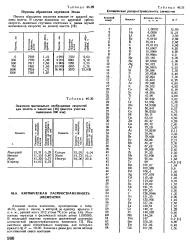 |
Периоды обращения спутников Земли.| Космическая распространенность элементов. [6] |
Атомные массы элементов, приведенные в табл. 46.31, даны в шкале, в которой за единицу принята 1 а. Значения даны для числа атомов естественной смеси изотопов. [7]
Атомные массы элементов, приведенные в периодической системе, - это средние массовые числа природных смесей изотопов. Поэтому они отличаются от целочисленных величин. Очевидно, атомная масса не может быть главной характеристикой атома, а значит и элемента. Такой характеристикой служит положительный заряд ядра атома. [8]
Атомные массы элементов могут быть определены из значений молекулярных масс соответствующих элементарных веществ, если только известно число атомов элемента в молекулах этих веществ. [9]
Атомные массы элементов - это среднее из атомных масс изотопов, поэтому они и не выражаются целыми числами. [10]
Атомные массы элементов могут быть определены из значений молекулярных масс соответствующих элементарных веществ, если только известно число атомов элемента в молекулах этих веществ. [11]
Атомные массы элементов приведены в Приложении XV ( стр. Менделеева, данной на форзаце. [12]
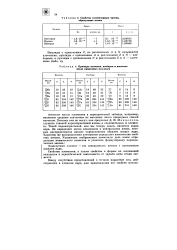 |
Свойства элементарных частиц, образующих атомы.| Примеры изотопов, изобаров и изотопов среди природных нуклидов. [13] |
Атомные массы элементов в периодической таблице, например, являются средним значением из массовых чисел природных смесей изотопов. Поэтому они не могут, как предлагал Д. И. Менделеев, служить главной характеристикой атома, а следовательно, и элемента. Такой характеристикой, как мы теперь знаем, является заряд ядра. Он определяет число электронов в нейтральном атоме, которые распределяются вполне определенным образом вокруг ядра. Характер же распределения электронов определяет химические свойства атомов. [14]
Атомные массы элементов могут быть определены из значений молекулярных масс соответствующих элементарных веществ, если известно число атомов в молекуле этих веществ. [15]
Страницы: 1 2 3 4