Атомные массы - элемент
Cтраница 3
Простое рассмотрение в этом случае показывает, что углеводородным остатком будет С2Н6, но в общем для нахождения значения п необходимо умножить его на атомные массы элементов, входящих в формулу, и их сумму приравнять массе остатка. [31]
В тех случаях, когда указан процентный состав вещества - содержание каждого элемента в 100 г вещества, - можно, разделив эти величины ( г / 100 г) на атомные массы элементов, найти количество молей атомов каждого элемента в 100 г вещества. Отношение этих мольных величин между собой и является отношением между числом атомов, входящих в состав одной молекулы. [32]
Поэтому значения массы остатка 31 и 29 невозможны и число 30 представляет молекулярную массу С Н2п 2 - Простое рассмотрение в этом случае показывает, что углеводородным остатком будет С2Н6, но в общем для нахождения значения п необходимо умножить его на атомные массы элементов, входящих в формулу, и их сумму приравнять массе остатка. [33]
Из-за довольно частых отклонений от истинных величин закон Дюлонга и Пти нередко называют правилом. Атомные массы элементов, найденные как по Дюлонгу и Пти, так и по Канниццаро, недостаточно точны из-за довольно значительных экспериментальных погрешностей, неизбежных при определении теплоемкости или процентного состава веществ. Наиболее точные значения атомных масс ( с точностью до одной стотысячной) были получены с помощью специальных приборов-масс-спектрографов, о чем подробно говорится в курсах физики. Найденная экспериментально одним из химических методов атомная масса может быть уточнена, если известны эквивалент и валентность элемента, В связи с этим вспомним, что называется валентностью. [34]
Под номером 2 стоит гелий, и так далее до элемента с номером 103 - лоуренсия. Атомные массы элементов показывают, во сколько раз атом данного элемента тяжелее атома водорода. [35]
При приготовлении точных растворов вычисление количеств нужных веществ проводят уже с достаточной степенью точности. Атомные массы элементов берут по таблице, в которой приведены их точные значения. [36]
Многие физические свойства элементов связаны с положением, которое они занимают в периодической системе. Так, атомные массы элементов возрастают с увеличением порядкового номера ( исключение из этого правила составляют пары Аг-К, Со-Ni, Те-I): к магнитному упорядочению способны только металлы с незаполненными 3 - и 4 - й оболочками ( исключением является твердый кислород), а сверхпроводящими свойствами в основном обладают парамагнитные переходные металлы четвертого - седьмого периодов; полупроводники располагаются в середине периодов в главных подгруппах III, IV и VI, а полуметаллы - в главной подгруппе V; все периоды заканчиваются диэлектрическими кристаллами. Отчетливую периодичность обнаруживают и другие физические свойства. [37]
Однако для элементов, не образующих простых газов, этот простой метод непригоден. Канниццаро предложил определять атомные массы элементов, используя для этого их летучие соединения. По Канниццаро, нужно определить молекулярные массы нескольких летучих соединений данного элемента, найти их процентный состав и вычислить долю от молекулярной массы, приходящуюся на данный элемент. Так как элемент не может быть представлен в своих соединениях меньше чем одним атомом, то наименьшая доля от молекулярной массы, которая приходится на данный элемент в различных соединениях, и будет его атомной массой. [38]
Некоторые поправки были внесены Д. И. Менделеевым в атомные массы элементов платиновой группы и редкоземельных элементов. [39]
Атомная единица массы равна 1 66057 10 - 27 кг. По отношению к атомной единице массы определяются атомные массы элементов, относительные молекулярные массы химических веществ и массы ядер. [40]
Томсон создал масс-спектрометр, с помощью которого он определил отношение заряда к массе у ионизированных атомов или молекул газов, наблюдая отклонение потока ионизированных частиц в электромагнитных полях. Астоном) Томсон обнаружил изотопы и определил атомные массы элементов. Оказалось, что, за исключением 22 так называемых чистых элементов, остальные элементы представляют собой смесь изотопов. [41]
Формула (17.42) является развитием известной формулы Макова [18], устанавливающей определенную корреляцию между D0 и молекулярной массой вещества. Предлагаемые значения AMj можно интерпретировать как условяые диффузионные атомные массы элементов, которые иногда действительно близки к атомной массе элемента. [42]
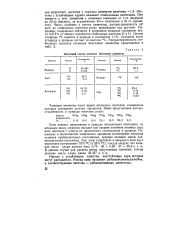 |
Изотопный состав основных биогенных элементов. [43] |
Если элемент представлен в природе несколькими изотопами, то атомную массу элемента находят как среднее значение атомных масс всех изотопов с учетом их процентного соотношения в природе. Поскольку в большинстве химических процессов соотношение изотопов остается приблизительно постоянным, средние атомные массы элементов также постоянны. [44]
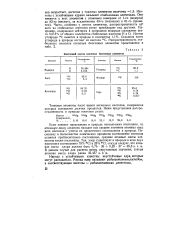 |
Изотопный состав основных биогенных элементов. [45] |
Страницы: 1 2 3 4