Ионная молекула
Cтраница 2
Когда ионные молекулы поглощают свет в момент наибольшего сближ ния ядер, то, как видно из рис. 21, небольшие вариации в значении г ведут к значительному изменению длины стрелок. [16]
Диссоциацией ионной молекулы называется распад ее на ионы. [17]
Образование ионных молекул определяется повышенной устойчивостью внешней восьмиэлектронной s - - p - подгруппы в атомах ( стр. Особая устойчивость восьмиэлектронной конфигурации объясняется тем, что при заполнении всех восьми состояний в s / - подгруппе она становится мало восприимчивой к внешним воздействиям ввиду полной компенсации орбитальных и спиновых моментов электронов ( стр. [18]
Образование ионной молекулы при сближении атомов осуществляется путем перехода внешних электронов от электроположительных к электроотрицательным атомам с образованием соответственно положительных и отрицательных ионов этих атомов. [19]
Для ионных молекул, пользуясь законом Кулона, сравнительно просто можно рассчитать энергию связи. [20]
Для типичных ионных молекул приблизительная величина энергии связи может быть легко вычислена. [21]
Существование отдельных ионных молекул возможно только в парах солей; в обычных условиях они не существуют. [22]
 |
Строение трехатомных ионов Na2Cl ( a, NaCl2 ( 6, молекул Na2Cl2 ( e и ионных кристаллов NaCl (. [23] |
Образование ионной молекулы Na Cl - не исключает сильного кулоновского взаимодействия составляющих ее ионов с другими ионами. Взаимное расположение ионов определяется их электростатическим взаимодействием. [24]
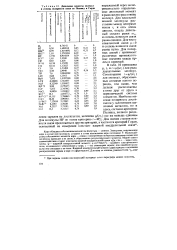 |
Дипольные моменты молекул в степень полярности связи по Полингу и Горди. [25] |
Для идеальной, ионной молекулы расстояние между центрами ионов ге и есть длина диполя, откуда дипольный момент равен еге, и степень ионности связи равна единице. Для чисто ковалентной связи ц 0 и степень ионности связи равна нулю. Для полярных связей У принимает различные промежуточные значения между нулем и единицей. [26]
Образование ионной молекулы типа соединения щелочного металла с галогеном энергетически выгодно именно потому, что затрата энергии на ионизацию щелочного металла с избытком покрывается сродством галогена к электрону и энергией, выделяемой при соединении ионов. [27]
 |
Пределы устойчивости для различных координационных чисел. [28] |
В изолированной ионной молекуле ( рис. 185) поляризационное действие имеет однорторонний характер и вызывает образование диполя и укорочение расстояния между центрами ионов. [29]
 |
Поляризация ионов в галоидных соединениях серебра.| Зависимость межатомных расстояний от координационного числа. [30] |
Страницы: 1 2 3 4 5