Енолят-ионы
Cтраница 2
НО и, кроме того, такие, как R0 - и енолят-ионы. Реакционная способность нуклеофилов в реакциях отщепления параллельна основности нуклеофилов в реакциях переноса протона. Вследствие этого такой нуклеофил, как RS, который своей реакционной способностью в основном обязан высокой поляризуемости, имеет тенденцию вызывать реакции замещения, а не отщепления. Очень сильные основания, такие, как H2N -, осуществляют преимущественно реакции: отщепления даже с первичными субстратами. [16]
Галогенированию подвергаются не сами альдегиды или ке-тоны, а соответствующие енолы или енолят-ионы. Цель катализа заключается в том, чтобы обеспечить образование небольшого количества енола или енолята. [17]
В отличне от енолят - ионов кетонов, 1 3-дикетонов и 1 3-кетоэфиров енолят-ионы сложных эфиров подвергаются региоспецифическому С - алкилированию и С-ацилированию независимо от природы уходящей группы, радикала и других факторов. Фактически с любым электрофильным агентом анионы сложных эфиров реагируют исключительно своим углеродным центром. В настоящее время разработаны превосходные общие методы моно - С-алкилирования, С-ацилирования литиевых енолятов сложных эфиров одноосновных и двухосновных карбоновых кислот. [18]
Помимо анионов нитроалканов в качестве нуклеофильных агентов в алифатическом S l - замещении могут быть использованы тиолят - ( К5) нитрит -, сульфинат - ( К8О2 -), цианид-ионы, а также енолят-ионы. В этом случае в качестве интер-медиатов также были зафиксированы соответствующие анион-радикалы. [19]
Кроме четкого вывода о том, что кетонная и енольная структуры иона С3Н6О различимы, а быстрый переход между ними в газовой фазе не имеет места, эти эксперименты приводят к очень интересному результату о том, что енолят-ионы, генерируемые тремя способами по реакциям ( 12), ( 13) и ( 14), неразличимы в ИЦР-спектрометре. [20]
Енолят-ионы относятся к числу классических представителей амбидентных анионов с двумя различными реакционными центрами: углеродом и кислородом, связанными в единую сопряженную систему. Енолят-ионы представляют собой самый важный класс амбидеитных анионов, чрезвычайно широко используемых в органическом синтезе, прежде всего для создания новой углерод-углеродной связи в реакциях алкилирования, ацилирования и различных конденсациях. Известны многочисленные примеры реакций и по углеродному и по кислородному центрам енолят-ионов. [21]
Аналогичным образом могут быть выделены и другие щелочные еноляты. Енолят-ионы кетонов и сложных эфиров стабильны, как правило, только при низкой температуре. В синтетической практике щелочные еноляты не выделяют, а сразу же используют для дальнейших превращений. [22]
Енолят-ионы кетонов реагируют с арил-галогенидами в условиях фотоинициирования с образованием а-арилкетонов с хорошими выходами. [23]
Образование енолят-ионов 1 3 - Дикарбонилъных соединений - малонового эфира, ацетоуксусного эфира и других 1 3-кетоэфиров облегчается при наличии двух электроноакцепторных заместителей - карбонильной и карбалкоксильной групп. Енолят-ионы малонового и ацетоуксусного эфира обладают более высокой стабильностью по сравнению с енолят-ионами кетонов и сложных эфиров одноосновных кислот вследствие более эффективной делокализации заряда с помощью обоих акцепторных заместителей. Это отражается на низкой величине рЛ а этих соединений. Щелочные соли малонового эфира и 1 3-кетоэфиров количественно получаются нз исходных С - Н кислот с помощью самых разнообразных оснований: СНзСЩОКа; ( СНз) зСОК; NaH, KH, ЛДА и др. в спирте или в апротоииой среде и легко могут быть выделены в индивидуальном виде и храниться в течение длительного времени. [24]
Такие модифицированные центры образуют с ионами субстрата смешанный промежуточный комплекс, гидрирование которого приводит к образованию оптически активных продуктов реакции. В то же время енолят-ионы с немодифицированными активными центрами катализатора могут образовывать прочные хелатные комплексы, гидрирующиеся, по-видимому, с меньшей скоростью. Этим, возможно, и объясняется уменьшение скорости реакции с увеличением исходной концентрации ацетоуксусного эфира. [25]
Однако имеются алкидные ионы слабоосновного характера и, следовательно, способные к расщеплению цепи. К таким ионам относятся енолят-ионы, образующиеся при расщеплении ( З - дикарбонильных соединений. [26]
Енолят-ионы сложрп1х эфиров являются близкими аналогами енолят-ионов альдегидов и кетонов. Подобно тому, как енолят-ионы альдегидов и кетонов присоединяются по карбонильной группе карбонильных соединений с образованием алъдолей, енолят-ионы сложных эфиров присоединяются по карбонильной группе сложного эфира. Принципиальное различие этих двух родственных по своему механизму конденсаций заключается в том, что в сложноэфирной конденсации есть уходящая группа OR ( OC2H5 % при отщеплении которой образуется 1 3-кетоэфир. [27]
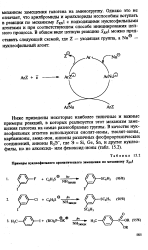 |
Примеры иуклеофильного ароматического замещения по механизму 5 1. [28] |
Ниже приведены некоторые наиболее типичные и важные примеры реакций, в которых реализуется этот механизм замещения галогена на самые разнообразные группы. В качестве нук-леофилъных агентов используются енолят-ионы, тиолят-ионы, карбанионы, амид-ион, анионы различных фосфорорганических соединений, анионы R33 -, где Э Si, Ge, Sn, и другие нуклео-филы, но. [29]
Дикетоны и эфиры ( З - кетонокислот легко расщепляются сильными основаниями. Вероятно, реакция протекает через промежуточные енолят-ионы. [30]
Страницы: 1 2 3 4