Барьер - вращение
Cтраница 2
Барьер вращения между конформациями Аи Б очень велик и составляет 14 ккал / моль. Это объясняется тем, что в конфор-мации А вакантная орбиталь очень сильно взаимодействует с одной из двух вырожденных ВЗМО циклопропанового кольца, а именно с той орбиталью ВЗМО ( 1), которая не имеет нулевого вклада от одного из атомов углерода ( молекулярные орбитали циклопропана рассматривались в гл. [16]
Барьер вращения - энергия, требуемая для превращения одной Информации в другую. Например, барьер вращения при переходе Заторможенной конформации этана ( наиболее устойчивая конформация - рнформер) в заслоненную конформацию ( наименее устойчивую) Определяется как AG и составляет 3 ккал / моль. [17]
Барьер вращения - энергия, требуемая для превращения одной конформации в другую. [18]
Барьер вращения фрагментов молекулы определяется энергией, требуемой для превращения одной конформации в другую. Энергия заслоненного взаимодействия каждой пары соседних С - Н - связей может быть оценена, таким образом, в 1 ккал / моль. [19]
Барьер вращения метильных групп относительно С-С - связи в этане, однако, столь мал, что невозможно в обычных условиях выделить указанные конформационные изомеры в качестве индивидуальных соединений. [20]
Барьеры вращения вокруг двойных связей в этилене, аллене и других еновых соединениях очень велики - порядка 30 - 50 ккал / моль. При обычных температурах тепловой энергии совершенно недостаточно для того, чтобы возбудить переходы одних изомеров в другие; поэтому замещенные этилена, кумуле-нов и подобных им молекул существуют в виде устойчивых геометрических изомеров. [21]
Барьер вращения вокруг двойной связи в простых алкенах ( этилен, бутен-2) достигает 250 - 270 кДж / моль. Если рядом с двойной связью имеются функциональные группы, вызывающие поляризацию этой связи или делающие ее частью сопряженной системы, барьер вращения снижается. Это зафиксировано, например, для соединений типа ABCCXY, где А, В - электронодонорные группы ( например, SR), а X, Y - электро-ноакцепторные группы ( например, CN, COOR); барьер вращения вокруг поляризованной таким образом связи снижается до 60 - 100 кДж / моль. [22]
Барьер вращения вокруг амидной связи в этом соединении равен 51 кДж / моль; в 2 2 6 6-тетраметильном аналоге он почти в 2 раза меньше ( 28 кДж / моль) [46] из-за повышенной энергии основного состояния. [23]
Рассмотрим барьеры вращения на примере низкомолекулярных соединений. Структура этапа СН3 - СН3 показана на рис. 4.7. Каждая группа СН3 может вращаться вокруг простой связи С - С. В этих положениях с минимумом потенциальной энергии [ / mm атомы водорода двух групп СН3 наиболее удалены друг от друга. При повороте группы СН3 атомы водорода обоих групп сближаются и для преодоления сил отталкивания необходима затрата дополнительной энергии, так называемой энергии активации. Для этана в газообразном состоянии она равна 12 кДж / моль. [24]
R барьер вращения может достигать 10 - 15 ккал / моль. [25]
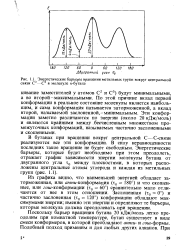 |
Энергетические барьеры вращения метияьных групп вокруг центральной связи С2 - С в молекуле к-бутана. [26] |
Поскольку барьер вращения бутана 20 кДж / моль легко преодолим при комнатной температуре, бутан существует в виде смеси конформеров, в которой преобладают анти - и гош-формы. Подобный подход применим и для любых других алканов. [27]
Однако барьер вращения вокруг двойной связи в дидейтероэтилене составляет 65 ккал / моль, тогда как энергетический барьер нитеркоиверсни анти - и гога-форм бутана составляет всего около 4 кк ал / моль. Поэтому оба стереоизомера дид ейтероэтилена совершенно стабильны даже при 100 С, в то время, как анти - и - гош-формы бутана перестают превращаться друг в друга только при - 230 С. Это различие в нитеркоиверсни обусловлено различными видом стереоизомерни и имеет поэтому различные обозначения. Анти - и гош-формы бутана называются конформационными изомерами, а два изомерных дид ейтероэтилена называют конфигурационными изомерами. [28]
Энергия барьера вращения вокруг связи С-С в этане составляет 3 ккал / моль. [29]
Значения барьеров вращения очень различны. Например, барьер внутреннего вращения этана равен 13 кДж / моль, а для некоторых переходов ( например, для атропизомерии) они столь велики, что внутреннее вращение становится невозможным при комнатной температуре, но легко происходит при повышенной температуре. Вообще с повышением температуры растет код-центрация или, как говорят, заселенность энергетически более богатых конформации. В ряде случаев скорость реакции зависит от энергии перехода обычной конформации в r - конформацию ( высоты барьера между ними) и вероятности этого перехода. Иными словами, скорость реакции зависит от мгновенной концентрации г-кон-формации в веществе. [30]
Страницы: 1 2 3 4