Активационный барьер - реакция
Cтраница 2
Образующиеся при первичной реакции радикалы взаимодействуют далее с исходным веществом. Действительно, активационный барьер реакций зарождения ( 1) и ( 2) сравним, а иногда и меньше, чем активационный барьер реакций продолжения цепи. [16]
В общем, ионы металлов будут катализировать реакции, ускоряемые кислотами, если при этом образуются промежуточные хелатные соединения. За счет поляризации снижается активационный барьер реакции. Иногда бывает, однако, что хорошие комплексообразователи с большим е2 / г каталитически мало активны. А ] 3 и Be24 не влияют на скорость бромирования аце-тоуксусного эфира, активными же катализаторами для этого процесса являются ионы - более сильные комплексообразователи: Со2 1, Си2 1, № а и др. Для объяснения отклонений от прямой связи каталитич. Пирсон) выдвинуто представление о том влиянии, к-рое оказывают изменения координации лигандов ( аддендов) вокруг комплексного иона переходного элемента на его реакционную способность. Согласно этим взглядам, для каталитич. В поле лигандов, к-рыми могут быть в частном случае и молекулы веществ, претерпевающих каталитич. [17]
Ограничения, так или иначе связанные с симметрией, представляют собой очень важный фактор, который всегда надо принимать во внимание при обсуждении возможного пути реакции. Запреты по симметрии обусловливают активационный барьер реакции. Если орбитальная симметрия сохраняется, то электронам сближающихся атомов необходимо занять более высокую орбиталь ( орбиталь с большей энергией) для образования связи, так как низшие уже заполнены; энергия орбитали быстро увеличивается при сближении атомов, разделенных узловой поверхностью. Если молекулярная орбиталь двух атомов имеет узел в области между двумя ядрами, то в силу сохранения симметрии этот узел тоже обнаружит тенденцию к сохранению. [18]
Энергия активации взаимодействия окислов определяется не только энергией образования переходного активационного комплекса, которая зависит от энергии связи, но и энергией, необходимой для осуществления переноса исходных компонентов через этот комплекс в реакционную зону. В тех случаях, когда активационный барьер реакции очень велик, образуются промежуточные продукты, у которых энергия активации образования меньше, чем у конечных равновесных продуктов. [19]
С точки зрения химика важно, что в активированном комплексе волновые функции - орбитали - основного и возбужденного состояний должны иметь одинаковую симметрию. Обычно рассматривают лишь первое возбужденное состояние и поэтому можно считать, что активационный барьер реакции будет небольшим, если первое возбужденное состояние близко по энергии к основному и имеет ту же симметрию. [20]
Тепловой эффект этой реакции неизвестен, так как неизвестна теплота образования циклопентадиена. Приближенная оценка дает для теплового эффекта значение - 28 ккал / моль, следовательно, активационный барьер реакции 30 8 ккал / моль. Для реакции дегидрирования циклопентана до циклопентена тепловой эффект минус 26 4 ккал / моль. [21]
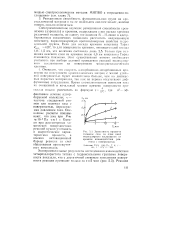 |
Зависимость прироста толщины слоя за один цикл молекулярного наслаивания от времени взаимодействия реагента с поверхностью. [22] |
Оценочные расчеты показывают, что уже при Рж Ю-6 Па т 1 с. Однако при рассмотрении химических поверхностных реакций нужно учитывать и энергетические характеристики процесса, а именно активационный барьер реакции за счет образования промежуточных комплексов. [23]
Наибольшая энергетическая эффективность плазмохимического процесса может быть достигнута лишь в том случае, когда этот процесс удается организовать в условиях неравновесных плазмохимических СВЧ - и ВЧ-раз-рядов. Проведение химического процесса в условиях неравновесной плазмы позволяет значительно снизить кинетическую температуру реагентов, а преодоление активационного барьера реакции достигнут за счет колебательной энергии, получаемой молекулами в зоне разряда. Другими словами, в условиях ВЧ-разряда наблюдается селективный вклад энергии в данный канал реакции, причем для проведения эндотермических реакций ( диссоциация паров воды, CU2, газификация твердого горючего и др.) наилучшими являются условия, когда процесс стимулируется колебательным возбуждением реагентов в разряде. [24]
Реакционная способность молекулярного водорода существенно зависит от температуры. Энергия связи в молекуле Н2 ( 436 кДж / моль) достаточно велика, и при стандартных условиях активационные барьеры реакций с участием молекулярного водорода не преодолеваются ( см. разд. Это позволяет при комнатной температуре ( и в темноте) существовать смесям водорода, например, с кислородом или хлором. Но уже при 200 - 400 С водород проявляет высокую химическую активность. [25]
Образующиеся при первичной реакции радикалы взаимодействуют далее с исходным веществом. Действительно, активационный барьер реакций зарождения ( 1) и ( 2) сравним, а иногда и меньше, чем активационный барьер реакций продолжения цепи. [26]
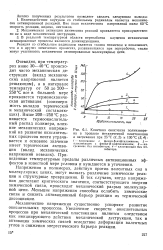 |
Кинетика окисления полиизопрена в процессе механической пластикации и нагревания при 25 С ( 1 2 и 130 С ( 3 4. [27] |
Напряжения в полимерах, действуя против валентных сил в молекулярных цепях, могут вызвать различные химические реакции и структурные превращения. В тех случаях, когда напряжения достигают критического значения, соответствующего энергии химической связи, происходит механический разрыв молекулярной цепи. Меньшие напряжения способны ослабить химические связи и снизить активационный барьер реакции их термической диссоциации. [28]
Наибольшая сложность в настоящее время существует в вычислении величины Ег. По сути это энергия, которая запасается в колебательных степенях свободы г-го компонента при его образовании в r - й химической реакции. В рассматриваемом случае ( модовая модель) столь детальная информация не требуется. Будем полагать, что при образовании молекулы в колебательные степени свободы выделяется энергия, равная колебательной энергии, идущей на преодоление активационного барьера реакции, протекающей в направлении уничтожения молекулы. [29]
Грин подчеркивает четыре основных принципа биоэнергетики: 1) конверсия тепловой энергии в электромеха-нохимическую, осуществляемая белком, 2) способность энерги-зованного фермента поляризовать чувствительные связи в молекуле субстрата, выполняющей цикл поляризации и деполяризации, 3) сопряжение переноса групп, 4) энергетическое сопряжение посредством комплементарных, векторных потоков зарядов в центрах экзергонических и эндергонических реакций. Фермент считается упругой трехмерной средой, совершающей колебания как целостная система. Молекулы белка периодически переходят из растянутого состояния в сжатое и обратно с частотами порядка 103 - 106 с -, отвечающими частотам ферментативных реакций. В ходе этих колебаний происходит переход одной формы энергии в другую, возникает конформация, соответствующая выполнению специфической работы, и понижается активационный барьер реакции превращения субстрата в продукт. Фермент есть машина, превращающая тепловую энергию в электромеханохимическую в фазе энергизации и выполняющая обратное превращение в фазе дезэнергизации. Грин возлагает надежды на исследования медленных колебаний ферментов методом комбинационного рассеяния с использованием лазерной техники. [30]
Страницы: 1 2 3