Нативные белок
Cтраница 1
Нативные белки либо вовсе не атакуются трипсином, либо перевариваются крайне медленно. [1]
Нативные белки характеризуются чрезвычайно специфическими конформациями, которые сравнительно легко могут быть нарушены различными воздействиями. Такие воздействия вызывают резкие изменения физико-химических свойств белка без нарушения их ковалентных связей. [2]
Нативные белки, альбумины и глобулины, имеют глобулярную структуру и относятся к глобулярным белкам. Такого типа белки в природе весьма распространены. Глобулярные белки иначг называются корпускулярными белками. Размеры этих глобул или корпускул могут достигнуть таких пределов, что коллоидные частицы состоят из отдельных глобул, что дает возможность определения молекулярного веса по методу Сведберга. [3]
Нативные белки характеризуются чрезвычайно специфическими конформациями, которые сравнительно легко могут быть нарушены различными воздействиями. Такие воздействия вызывают резкие изменения физико-химических свойств белка без нарушения их ковалентных связей. [4]
Расщепляет нативные белки, фрагменты пепсинного перевара, а также высшие пептиды. Расщепляет пептидные связи внутри цепи, в которых участвуют карбоксильные группы аргинина - и лизина. Оптимальные условия действия: рН 7 - 8, температура 25 - 37 С. [5]
Известны нативные белки ( например, кератин волос), поверхностный слой которых гид-рофобен, а внутренние его слои гидрофильны. [6]
Устойчивость нативных белков к действию протеоли-тических ферментов связана, вероятно, с отсутствием в этих белках точек, на которые могли бы действовать молекулы фермента. При денатурации же белковой молекулы происходит развертывание пептидных цепей, в результате чего структуры, необходимые для действия фермента, становятся доступными и протеолиз может быть осуществлен. Такими группами для трипсина являются боковые цепи аргинина или лизина, имеющие щелочной характер ( см. стр. В нативных белках эти группы скрыты внутри глобулы и потому недоступны для действия фермента; небольшие же ионы водорода могут проникать к этим группам, вследствие чего они титруются кислотами. Появление этих групп на поверхности развернутых денатурированных молекул объясняет не только гидролиз этих молекул трипсином, но и возникновение межмолекулярных соле-образных связей и образование нерастворимых коагулятов ( см. стр. [7]
В переваривании нативных белков и продуктов их гидролиза в тонком кишечнике активное участие принимают экзопептидазы. Карбоксипептидазы синтезируются в неактивном состоянии в поджелудочной железе и активируются трипсином в кишечнике. Карбоксипептидаза А гидролизует пептидные связи С-концевых аминокислот, образованные преимущественно ароматическими аминокислотами ( фенилаланин, тирозин, триптофан), а карбоксипептидаза В - связи, в образовании которых участвуют С-концевые лизин и аргинин. [8]
При выделении нативных белков стремятся, как можно меньше изменить ( денатурировать) белок, чтобы получить его с первоначально присущей ему структурой и со всем комплексом имеющихся в нем свойств. [9]
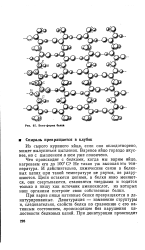 |
Бета-форма белка. [10] |
При варке пищи нативные белки превращаются в денатурированные. [11]
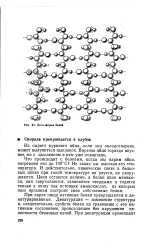 |
Бета-форма белка. [12] |
При варке пищи нативные белки превращаются в денатурированные. [13]
Известно, что нативные белки обладают гораздо меньшим отрицательным вращением, чем денатурированные белки. Это позволило предположить, что такие изменения во вращении связаны с потерей спираль-ности. Уравнение, выражающее свойства ДОВ а-спи-ральных полипептидов, было использовано в качестве основы для оценки содержания се-спиралей во многих типах синтетических полипептидов и белков. Рассмотрение этой проблемы с теоретической точки зрения допускает связывание экситонов и показывает, что сильные эффекты Коттона противоположных знаков ( куплет) должны возникать в результате каждого сильного электронного перехода, такого, как п - я-переход при 190 нм. Позднее показано, что для неопределенно длинной спирали они вызывают появление другого куплета. Такой более точный подход с точки зрения экситонной теории позволяет предсказать четыре полосы для каждого сильного поглощения. Для а-спирали их появление ожидается при 185, 189 и 193 нм. Кроме того, как показано в разд. [14]
Хорошим примером изучения нативных белков является исследование белков сыворотки крови, включающее их выделение, очистку, количественный и качественный анализ. Широкое применение методов анализа белков будет показано нами именно на примере изучения сывороточных белков. [15]
Страницы: 1 2 3 4