Нативные белок
Cтраница 2
Кроме того, поскольку нативные белки находятся в водном окружении, то при строгом подходе необходимо учитывать свободную энергию всей системы, включающей белковую цепь и растворитель. [16]
Недостоверность определения молекулярной массы нативных белков заставила искать такой способ использования гель-фильтрации, при котором эта неопределенность была бы сведена к минимуму. Решение было найдено за счет отказа от сохранения нативности белка и перехода к его полной денатурации, с диссоциацией субъединиц и разрывом всех внутримолекулярных связей, в том числе и дисульфидных мостиков. Образующиеся при такой глубокой денатурации полипеитидные цепи белка сворачиваются в рыхлые статистические клубки, размер которых ( стоксов радиус) зависит только от длины цепи. Различиями аминокислотного состава, разумеется, приходится пренебречь, полагая, что для достаточно крупных ( и не уникальных по составу) белков аминокислотный состав в среднем одинаков. [17]
В том же номере журнала описано разделение нативных белков с молекулярными массами в интервале 13 - 340 тыс. Дальтон на колонке Varian MicroPak TSK GEL 3000 SW размером 0 75 х 30 см. При среднем диаметре гранул 10 мкм скорость элюции здесь также составляла около 140 мл / см2 - ч, так что все поставленные выше вопросы относятся и к этой работе. [18]
При 0 05 М концентрации ионов С1 - нативные белки хорошо связываются с ДЭАЭ-целлюлозой. Несвязавшиеся компоненты фракционируемой смеси удаляют, промывая колонку одним объемом буферного раствора. [19]
В последние годы благодаря развитию аналитических методов изучение нативных белков приобретает все возрастающее значение как в химических, биохимических и медицинских исследованиях, так и в клинической практике. В книге, целью которой является детальное описание методов анализа белка, было бы затруднительно давать подробный обзор результатов, полученных при использовании того или иного метода, и вполне естественно, что этого нельзя требовать от руководства, предназначенного для определенных практических задач. [20]
Отсюда следует вывод, что определение молекулярной массы нативных белков с помощью гель-фильтрации, даже проведенное на уровне описанного выше современного подхода к этой задаче, может дать лишь приближенный результат. Тем более это справедливо в случае весьма распространенного упрощенного способа использования калибровочных кривых, построенных по молекулярным массам маркерных белков без учета их формы. То же относится к определению гель-фильтрацией молекулярных масс нативных нуклеиновых кислот с помощью маркерных НК известной массы, когда в число таких маркеров тРНК включают наряду с рибосомаль-ными РНК, а нередко и фрагментами ДНК. Говорить же серьезно об определении молекулярных масс НК с помощью калибровочных графиков, построенных для белков, что иногда еще можно встретить в литературе, но приходится. [21]
Например, в 1979 г. было описано фракционирование нативных белков с молекулярными массами 12 - 68 тыс. Дальтон на колонках Lichrosorb-DIOL ( 5 мкм) размерами 0 6 х 25 и 2 3 х 25 см. Авторы сообщили об успешном разделении классического набора стандартных белков ( БСА, овальбумин, химотрипсиногеп, лизоцим, цитохром с), о линейной зависимости log M от VR и подчеркнули, что все фракционирование у них занимало 6 мин. Если мы сравним эту цифру с той, что была приведена выше при описании построения калибровочного графика ( см. рис. 72) для сефадекса G-75 Superfine с использованием тех же белков, то увидим, что скорости элюции различаются более чем в 100 раз. Возникает вопрос - правомерно ли такое увеличение скорости, если иметь в виду, что средний диаметр гранул уменьшен только в 5 - 6 раз. Успевает ли установиться равновесие поперечной диффузии между фазами. Имеется ли выигрыш в эффективности разделения фракций, который можно ожидать от ЖХВД, или авторы пожертвовали им ради скорости процесса. Кстати говоря, такая жертва может быть целесообразной при работе с очень лабильными белками, но в большинстве случаев биохимик-исследователь, вероятно, предпочел бы увеличить длительность опыта до часа или даже нескольких часов, если бы это сулило ему существенный выигрыш в разрешении белковых фракций. Только ради экономии времени вряд ли имеет смысл в биохимической лаборатории идти на внушительные затраты средств, связанные с приобретением колонок и аппаратуры для ЖХВД. [22]
Уже много лет назад было известно, что некоторые нативные белки устойчивы к действию трипсина и что протеолиз легко протекает после денатурации белков. Зная количество основных аминокислот в белке, можно точно предсказать, сколько пептидов может образоваться при триптическом гидролизе денатурированного белка. [23]
Уже было отмечено, что под влиянием различных воздействий нативные белки претерпевают глубокие изменения, денатурируются. Сущность процесса денатурации белка заключается в развертывании глобулы полностью денатурированный глобулярный белок превращается в фибриллярный. [24]
Эти данные дают основание заключить, что структура молекул нативных белков настолько лабильна, что она может нарушаться даже в результате столкновения с находящимися в растворе молекулами мочевины. Никакие другие компоненты клетки не обладают подобной лабильностью. [25]
В дальнейшем была сделана попытка определить длину полипептидных цепочек нативных белков. [26]
В следующих двух главах будет показано, каким образом полипептидные цепи нативных белков свертываются и приобретают характерную для них специфическую конформацию и как эта конфор-мация зависит от аминокислотной последовательности. [27]
Электрофорез и классические иммунологические реакции также используются для сравнения белковых смесей и отдельных нативных белков. Однако разрешающая способность этих методов ограничена, так как они дают либо физико-химическую, либо имму-нохимическую характеристику. [28]
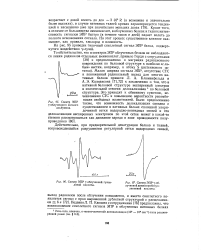 |
Спектр ЭПР.| Спектр ЭПР - облученной гуани-ловой кислоты.| Спектр ЭПР f - об. [29] |
Малая ширина сигнала ЭПР, отсутствие СТС и пониженный радикальный выход для многих нативных белков привели Л. А. Блюменфельда и А. Э. Калмансона [71,72] к заключению о том, что в нативной белковой структуре неспаренный электрон в значительной степени делокализован J по белковой структуре. Это приводит к обменному сужению, исчезновению СТС и повышению вероятности рекомбинации свободных валентностей. [30]
Страницы: 1 2 3 4