Нативные белок
Cтраница 3
 |
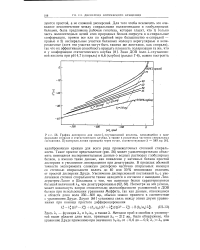
Двухступенчатая очистка одного из негистоновых щелочных белков хроматина тимуса ( белок АК методом гель-фильтрации на биогеле Р-60. [31] |
В этом разделе были высказаны общие соображения и приведены примеры, относящиеся к очистке и фракционированию нативных белков. Полная денатурация белков производится при оценке их молекулярной массы методом гель-фильтрации. Особенности хроматографии денатурированных белков рассмотрены ниже, в соответствующем разделе. [32]
Развертывание пептидных цепей при денатурации подтверждается тем, что денатурированные белки дают более интенсивные цветные реакции, чем нативные белки. [33]
Электрофорез в крахмальном геле имеет не только большое значение при диагностике парапротеинемий: он весьма важен при определении гомогенности нативных белков и полезен при анализе субъединичной структуры молекулы белка. Например, папаиновые фрагменты IgG ( Fab, Fc и Fc) или выделенные из него полипептидные цепи ( Н - и L-цепи) при электрофорезе в крахмальном геле образуют отдельные зоны. Это позволяет сравнивать субъединицы гомогенных IgQ ( миеломных белков или чистых антител) между собой. [34]
Растворы денатурированных белков при прочих равных условиях имеют более высокую вязкость и более низкое поверхностное натяжение по сравнению с растворами нативных белков. [35]
Если рассматривать проблему денатурации с энергетической точки зрения, то представляется очевидным, что должен существовать какой-то энергетический барьер, защищающий нативные белки от денатурации, которая могла бы наступить в результате тепловых колебаний пептидных цепей. В случае преодоления этого барьера денатурирующим агентом, пептидные цепи освобождаются. [36]
В последние годы применяют более тонкий метод разделения белков плазмы крови - иммуноэлектрофорез, при котором в электрическом поле передвигаются не нативные белки, а комплексы белковых молекул, связанных со специфическими антителами. [37]
Такое простое представление ( рис. 56) может удовлетворительно объяснить имеющиеся экспериментальные данные о водных растворах глобулярных белков, а именно такие данные, как появление у нативных белков простой дисперсии и увеличение левовращения при денатурации. В пределах обычной точности эксперимента сложную дисперсию частично спиральных молекул со степенью спиральности вплоть до 40 или 50 % невозможно отличить от простой дисперсии Друде. Несмотря на эти успехи, может возникнуть вопрос относительно целесообразности усложнений в ДОВ белков при использовании уравнения Моффита, так как данные, относящиеся к области длин волн 350 - 600 м и, обычно можно привести в соответствие с уравнением Друде. [39]
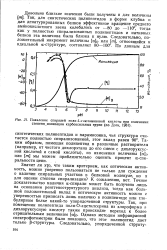 |
Плавление спиралей поли -. - глютаминовой кислоты при изменении степени ионизации карбоксильных групп ( по Доти, 1961. [40] |
Так, для синтетических полипептидов в форме клубка и для денатурированных белков эффективное вращение среднего аминокислотного звена колебалось от - 80 до - 110, тогда как у полностью спирализованных полипептидов и нативных белков эта величина была близка к нулю. [41]
Ввиду этого, прежде чем перейти к описанию определения методом гель-фильтрации молекулярных масс денатурированных белков, имеет смысл в качестве иллюстрации кратко процитировать хотя бы три практически полезных примера определения молекулярной массы нативных белков и пептидов. [43]
Третьим характерным свойством белковых веществ, отличающим их от всех других присутствующих в клетке соединений, является способность к денатурации. Нативные белки денатурируются под действием тех же самых физических или химических агентов, которые убивают или повреждают живые клетки. [44]
Трипсин ускоряет гидролиз пептидных связей белков, альбумоз и пептонов. Многие нативные белки лишь с трудом расщепляются трипсином. Триптический гидролиз таких белков идет значительно быстрее после их денатурации или после предварительного расщепления пепсином. Продуктами триптического гидролиза являются поли - и Дипептиды и аминокислоты. [45]
Страницы: 1 2 3 4