Глобулярный белок
Cтраница 3
Если сравнить аминокислотные последовательности миоглоби-на ( кита) и гемоглобина ( лошади и человека), кажется очевидным, что и тот и другой произошли от общего глобулярного белка. На рис. 10.27 изображена предполагаемая картина такой дифференциации в ходе эволюции. [31]
Поэтому для гетерогенного набора коротких цепей область температур перехода должна быть широкой. Хотя в молекуле глобулярного белка спирализованные участки не могут быть длинными ( ТТбскбльку ТТШПШеТШ1д1йьТ цеп й - слож ным - - о б) а - - зом свернуты, образуя компактную структуру), для белка наблюдаются резкие переходы. [32]
Помимо этого природного субстрата, который состоит из N-ацетилмураминовой кислоты иЫ - аце-тилглюкозамина, лизоцим катализирует также гидролиз хитина ( поли - М - ацетил - 3-глюкозамина) и продуктов его разложения, а также некоторых ( З - арилди - М - хитобиозидов. Подробно изучена трехмерная структура лизоцима: он представляет собой глобулярный белок, по форме отдаленно напоминающий бабочку, одно крыло которой содержит значительное количество спиральных фрагментов, а другое состоит в основном из складчатых р-структур. Активный центр расположен между крыльями и организован в виде щели, или впадины, способной вмещать длинноцепочечную полимерную молекулу природного субстрата. [33]
Уже было отмечено, что под влиянием различных воздействий нативные белки претерпевают глубокие изменения, денатурируются. Сущность процесса денатурации белка заключается в развертывании глобулы полностью денатурированный глобулярный белок превращается в фибриллярный. [34]
 |
Схема антипараллельной цепной структуры белка, обнаруженной в волокнах шелка. [35] |
Кендру и его сотрудникам удалось точно установить структуру глобулярного белка миоглобина. Как показал рентгеноструктурный анализ кристаллов миоглобина, молекула этого белка содержит полипептидную цепь, которая не вся является единой спиралью, а содержит восемь коротких сегментов, имеющих конформацию альфа-спирали, связанных неспиральными участками. Такая особенность трехмерной структуры полипептидной цепи - расположение в пространстве участков с правильной ( повторяющейся) структурой ( вторичной структурой) - называется третичной структурой белка. [36]
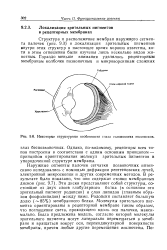 |
Некоторые структурные особенности глаза головоногих моллюсков. [37] |
Наружные сегменты палочек сетчатки позвоночных интенсивно иследовались с помощью дифракции рентгеновских лучей, электронной микроскопии и других современных методов. Эти диски представляют собой структуры, состоящие из двух слоев глобулярного белка ( в основном это зрительный пигмент родопсин) и слоя липидов ( главным образом фосфолипидов) между ними. Родопсин составляет большую долю ( - 85 %) мембранного белка. Молекулы зрительного пигмента ориентированы в рецепторной мембране таким образом, что поглощение света, проходящего вдоль оси палочки, максимально. Была предложена модель, согласно которой молекулы зрительного пигмента могут латерально перемещаться в мембране и вращаться вокруг оси, перпендикулярной поверхности мембраны, причем любые другие перемещения исключены. [38]
Первое из них следует приписать ионизации карбоксильных групп, второе - нейтрализации кати-онных аминогрупп. Общая форма кривых зависимости АУтах - рН очень напоминает кривые титрования глобулярного белка в объеме раствора. Несмотря на сходство кривых зависимости л - А, разные белки ясно различаются механическими свойствами монослоев и гистерезисными явлениями, которые обычно обнаруживаются в таких пленках. Жоли [43] установил, что поверхностная вязкость монослоя зависит от условий растекания белка по поверхности. [39]
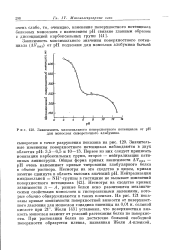 |
Зависимость максимального поверхностного потенциала от рН для монослоя сывороточного альбумина. [40] |
Первое из них следует приписать ионизации карбоксильных групп, второе - нейтрализации кати-онных аминогрупп. Общая форма кривых зависимости AFmax - рН очень напоминает кривые титрования глобулярного белка в объеме раствора. Несмотря на сходство кривых зависимости п - А, разные белки ясно различаются механическими свойствами монослоев и гистерезисными явлениями, которые обычно обнаруживаются в таких пленках. Жоли [43] установил, что поверхностная вязкость монослоя зависит от условий растекания белка по поверхности. [41]
 |
Конфигурация полипептидной цепи. [42] |
Нетрудно видеть, что новейшие представления о структуре белковых частиц хорошо объясняют возможность превращения в некоторых случаях глобулярных белков в белки фибриллярные. Для этого, очевидно, необходимо только развертывание полипептидных цепей в частице глобулярного белка под влиянием тех или иных внешних факторов. [43]
Вторичной структурой называют вытянутую или спиральную конформа-цию полипептидных цепей. Третичная структура соответствует тому, каким образом изогнута или сложена полипептидная цепь при образовании компактной молекулы глобулярного белка. Общее понятие конформации объединяет вторичную и третичную структуры. [44]
Наличие лиганда не обязательно приводит к существенно иной конформации свернутого белка, но способствует стабилизации его нативной формы. На основании опытов по водородному обмену [415], а также с помощью кривых денатурации мочевиной [461] апомиоглобина, глобулярного белка с А0общ 9 ккал / моль, установлено, что этот белок должен быть на 4 ккал / моль менее стабилен, чем миоглобин. Противоположным примером является цитохром с, присутствие в котором ковалентно связанной группы тема абсолютно необходимо для стабильности белковой структуры. [45]
Страницы: 1 2 3 4