Рибосомные белок
Cтраница 1
Рибосомные белки характеризуются в основном глобулярной компактной конформацией, с развитой вторичной и третичной структурой. Одно время широко распространилось убеждение, что рибосомные белки являются особенными, не похожими на обычные глобулярные белки; сообщалось об их сильно вытянутой или сильно рыхлой конформации, иногда разветвленной по всей рибосомной субчастице. Однако скоро стало понятно, что рыхлые конформации изолированных рибосомных белков представляют собой артефакт, являющийся следствием низкой стабильности их нативной конформации вне рибосомы. Конформация рибосомных белков стабилизируется при взаимодействии с РНК и друг с другом. [1]
Другие рибосомные белки, взаимодействующие с рибосомной РНК, требуют для образования достаточно прочных комплексов с ней также и присутствия хотя бы одного или нескольких сердцевинных - РНК-связывающих белков. [3]
Рибосомные белки большинства животных представлены в осн. Рибосомиые белки характеризуются глобулярной компактной конформапией с развитой вторичной и третичной структурой; они занимают преим. В отличие от вирусных нуклеопротеидов в структурно асим. [4]
Кроме рибосомных белков существуют еще три необходимых для инициации белка, известных под названием факторов инициации: IF-1, IF-2 и IF-3. Последний существует по меньшей мере в двух формах: IF-За и IF-Зр. Роль фактора инициации IF-3 состоит, по-видн-мому, в образовании инициационного комплекса мРНК - 16S - PHK ( рис. 15 - 15, стадия а) и в его стабилизации. Связыванию IF-2 комплекса каким-то образом помогает третий инициирующий фактор IF-1, роль которого до конца не выяснена. [5]
Роль отдельных рибосомных белков в ассоциации субчастиц изучена слабо. Она может состоять как в стабилизации структур РНК, осуществляющих ассоциацию, так и в непосредственном вкладе в межсубчастичные контакты. [6]
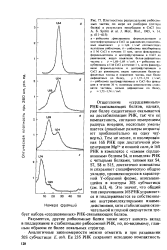 |
Плотностное распределение рибосом-ных частиц по мере их разборки ( потери белка в результате инкубации в CsCl ( по A. S. Spirit. et al. J. Mol.. Biol., 1965, v. 14, p. 611 - 615. [7] |
Разумеется, другие рибосомные белки также могут вносить вклад в поддержание и стабилизацию рибосомной РНК, но, по-видимому, главным образом ее более локальных структур. [8]
Молекулярные массы рибосомных белков варьируют в основном от 10000 до 30000 дальтон, и лишь единичные белки достигают массы около 60000 - 70000 дальтон. В прокариотических рибосомах малая ( 30S) субчастица содержит около 20, а большая ( 50S) - около 30 различных белков. [9]
Таким образом, рибосомные белки не отличаются принципиально от обычных растворимых глобулярных белков по своей компактности и общей степени свернутости полипептидной цепи во вторичные и третичные структуры. [10]
Полное аналитическое разрешение всех рибосомных белков достигается с помощью двумерного гель-электрофореза в денатурирующих условиях. [11]
Не исключено, что некоторые рибосомные белки могут не иметь собственного сродства к рибосомной РНК и удерживаться только за счет белок-белковых взаимодействий. [13]
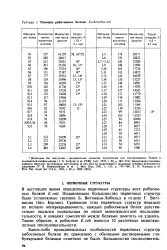 |
Размеры рибосомных белков Escherichia coli. [14] |
Каких-либо принципиальных особенностей первичных структур рибосомных белков по сравнению с обычными растворимыми глобулярными белками отмечено не было. [15]
Страницы: 1 2 3 4 5

