Рибосомные белок
Cтраница 2
Синтез рибосомных РНК строго скоординирован с синтезом рибосомных белков так, что в клетках в заметных количествах не обнаруживается ни свободных рибосомных РНК, ни свободных рибосомных белков. Скорость образования рибосом регулируется: в быстро растущих на богатых питательных средах культурах эта скорость высокая, в медленно растущих на бедных средах - низкая. Механизмы координированной регуляции синтеза компонентов рибосом отличаются большой сложностью и изучены еще недостаточно. Здесь будет рассмотрен только один элемент этой регуляции, основанной на взаимодействии с РНК-полимеразой низкомолекулярного эффектора гуанозинтетрафосфата. Этот нуклеотид синтезируется на рибосомах в условиях аминокислотного голодания клеток. Накопление гуанозинтетрафосфата в голодающих по аминокислотам клеткам приводит к значительному замедлению синтеза рибосомных РНК и мРНК рибосомных белков и может стимулировать транскрипцию оперонов биосинтеза аминокислот. [16]
Синтез рибосомных РНК строго скоординирован с синтезом рибосомных белков так, что в клетках в заметных количествах не обнаруживается ни свободных рибосомных РНК, ни свободных рибосомных белков. Скорость образования рибосом регулируется: в быстро растущих на богатых питательных средах культурах эта скорость высокая, в медленно растущих на бедных средах - низкая. Механизмы координированной регуляции синтеза компонентов-рибосом отличаются большой сложностью и изучены еще недостаточно. Здесь будет рассмотрен только один элемент этой регуляции, основанной на взаимодействии с РНК-полимеразой низкомолекулярного эффектора гуанозинтетрафосфата. Этот нуклеотид синтезируется на рибосомах в условиях аминокислотного голодания клеток. Накопление гуанозинтетрафосфата в голодающих по аминокислотам клеткам приводит к значительному замедлению синтеза рибосомных РНК и мРНК рибосомных белков и может стимулировать транскрипцию оперонов биосинтеза аминокислот. [17]
Синтез рибосомных РНК строго скоординирован с синтезом рибосомных белков так, что в клетках в заметных количествах не обнаруживается ни свободных рибосомных РНК, ни свободных рибосомных белков. Скорость образования рибосом регулируется: в быстро растущих на богатых питательных средах культурах эта скорость высокая, в медленно растущих на бедных средах - низкая. Механизмы координированной регуляции синтеза компонентов-рибосом отличаются большой сложностью и изучены еще недостаточно. Здесь будет рассмотрен только один элемент этой регуляции, основанной на взаимодействии с РНК-полимеразой низкомолекулярного эффектора гуанозинтетрафосфата. Накопление гуанозинтетрафосфата в голодающих по аминокислотам клеткам приводит к значительному замедлению синтеза рибосомных РНК и мРНК рибосомных белков и может стимулировать транскрипцию оперонов биосинтеза аминокислот. [18]
Такая последовательная трансляция цистронов обеспечивает экви-молярность продукции рибосомных белков в пределах данной поли-цистроновой мРНК Отсутствие диссоциации рибосом ( или, по крайней мере, их 30S субчастиц) от мРНК после терминации трансляции и отсутствие независимой инициации внутренних цистронов свободными рибосомами как характерная черта трансляции полицистронных мРНК, кодирующих рибосомные белки, является наиболее приемлемым объяснением полученных фактов. [19]
Вместе с тем, по крайней мере некоторые рибосомные белки могут иметь некомпактные хвосты. С-концевой последовательности, кончающейся несколькими глютаминовыми остатками подряд, которая вряд ли включена в глобулярную часть белка. К он имеет дополнительную последовательность на С-конце, которая, по-видимому, не является необходимой частью его глобулярной структуры. [21]
Район str-spc содержит 4 оперона, кодирующих 27 рибосомных белков, а также EF-TU, EF-G и а-субъединицу РНК-полимеразы. Район rif имеет 2 оперона, кодирующих 4 рибосомных белка, а также Р - и Р - субъединицы РНК-полимеразы. [22]
Известно, что бактериальная клетка не допускает избыточной продукции рибосомных белков. Практически их синтезируется столько, сколько требуется для сборки рибосом, в соответствии с количеством образующейся рибосомной РНК, и сколько-нибудь серьезного избытка свободных рибосомных белков в нормальной клетке не бывает. Поразительно одинаковый и координированный уровень продукции всех 52 рибосомных белков достигается несмотря на то, что их гены вовсе не организованы в единый регулируемый блок, а представлены независимыми приблизительно 16 оперонами, распределенными по геному клетки. [23]
Молекулярную основу этого различия следует искать в аминокислотном составе рибосомных белков у обычных и галофильных микроорганизмов. [24]
В этих условиях мРНК оказываются не конкурентоспособными, не связывают рибосомные белки и могут нормально транслироваться. Однако когда рибосомных белков становится больше, чем доступной рибосомной РНК, появляется их избыток в свободном состоянии. Это приводит к связыванию соответствующих ключевых белков со своими мРНК, давая в результате ингибирование инициации и репрессию трансляции. Строго последовательная трансляция полицистронных мРНК, кодирующих ряд рибосомных белков, делает возможным существование только одного репрессорного белка и одного места его действия на каждую мРНК для координированной репрессии трансляции всего ряда кодируемых белков. Этот простой механизм обеспечивает прямую регуляторную связь между сборкой рибосом и синтезом-рибосомных белков. [25]
Из явления разворачивания рибосомной частицы в рибо-нуклеопротеидный тяж, без отделения рибосомных белков, прямо следовало важнейшее заключение, что именно кова-лентно-непрерывная РНК удерживает на себе многочисленные рибосомные белки, являясь, таким образом, структурным каркасом для их размещения. В свое время это был новый принцип, так как изученные ранее случаи вирусных нуклеопротеидов представляли противоположный пример симметричной самоукладки белков в специфическую четвертичную структуру, с подгонкой РНК под нее. [27]
 |
Сравнение предсказанных вторич - 16S РНК. [28] |
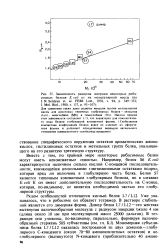
Номура с сотрудниками предложили очень изящную модель координированной регуляции синтеза всех рибосомных белков. Модель основана на идее о конкуренции между рибосомной РНК и мРНК за связывание с сердцевинными рибосомными белками. Такие белки, как S4, S7, S8, LI, L4, а также белковый комплекс L10 - ( L7 / L12) 4, имеют сильное сродство к специфическим местам прикрепления на рибосомных РНК, и поэтому по мере их синтеза они немедленно вовлекаются в процесс сборки рибосомных частиц, связываясь с 16S и 23S РНК соответственно. [29]
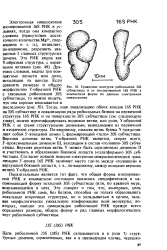 |
Сравнение контуров рибосомной 30S субчастицы и ее изолированной 16S РНК в компактной форме по данным электронной микроскопии. [30] |
Страницы: 1 2 3 4 5