Исходный белок
Cтраница 2
В отличие от этого кислотный гидролиз сывороточного альбумина приводит к образованию фрагментов, проявляющих иные сорбционные свойства по сравнению со свойствами исходного белка. Анализ взаимодействия белков с ионообменными смолами весьма существен для развития представления о механизме межмолекулярных взаимодействий белков с другими электролитами и полиэлектролитами. Так, например, взаимодействие фермент-субстрат в том случае, когда субстрат является электролитом, также должно определяться и расположением ионогенных заряженных групп в обеих молекулах. [16]
При так называемом ограниченном протеолизе среди конечных продуктов реакции были обнаружены и белки, но они представляют собой несколько видоизмененную форму исходного белка. К тому времени, когда процесс останавливается, гидролизованными оказываются только очень немногие пептидные связи. При этом превращении в молекуле яичного альбумина сохраняется весь фосфор, но происходит отщепление шести атомов азота [474] в виде гексапептида, структура которого была рассмотрена выше [ 397в ] ( стр. [17]
Далее преподаватель рассказывает, что склеропроте-ины растворяются только в концентрированных кислотах и щелочах при нагревании, но этот процесс сопровождается деструкцией макромолекул, из раствора исходный белок не регенерируется. Растворимые белки встречаются в клетках в растворенном состоянии - это альбумины, растворяющиеся в воде и в электролитах, и глобулины, растворяющиеся только в электролитах. [18]
Поскольку только Е - фрагмент имеет W-концевой Val и только Н - фрагмент имеет концевой Leu, ясно, что эти пептиды являются концевыми фрагментами исходного белка. Порядок расположения F и G в исходном белке на этой стадии исследования структуры определить невозможно, и тогда структуру этого белка можно представить формулой E ( F, G) H, где запятая и скобки означают, что порядок связи заключенных в них фрагментов неизвестен. Предположим, что исходный белок можно расщепить другим способом на четыре других фрагмента W, X, Y, Z, с показанной структурой. [19]
Белок может образовать комплекс с поверхностноактивным веществом, который, как правило, по своей растворимости и вообще по всем другим физическим и биохимическим свойствам заметно отличается от исходного белка. [20]
При действии азотнортутного реактива белки сначала образуют осадок белого ртутного соединения ( см. опыт 280); этот осадок окрашивается в розовый или красный цвет лишь в том случае, если исходный белок имеет в составе молекулы остатки тирозина или триптофана. Тирозин, или / г-оксифениланилин, содержит фенольный гидроксил; триптофан, или 3-индолилаланин, является гетероциклическим соединением. Некоторые белки, например чистый желатин, почти не содержат ни тирозина, ни триптофана и не дают при азотнортутной реакции характерного окрашивания; в то же время многие фенолы сами дают эту реакцию в отсутствие белко В. В присутствии некоторых неорганических соединений - перекиси водорода, хлоридов и других солей - четкость реакции резко снижается. [21]
При действии азотнортутного реактива белки сначала выпадают из раствора в виде белого ртутного соединения ( см. опыт 280); этот осадок окрашивается в розовый или красный цвет лишь в том случае, если исходный белок имеет в составе молекулы остатки тирозина или триптофана. Тирозин, или n - оксифенилаланин, HOCeH4CH2CH ( NH2) COOH содержит фенольный гидрок-сил; триптофан, или ( 3-индолилаланин, является гетероциклическим соединением. Некоторые белки, например чистый желатин, почти не содержат, ни тирозина, ни триптофана и не лают при азотнортутной реакции характерного окрашивания; в то же время многие фенолы сами дают эту реакцию в отсутствие белков. В присутствии некоторых неорганических соединений-перекиси водорода, хлоридов и других солей-четкость реакции резко снижается. [22]
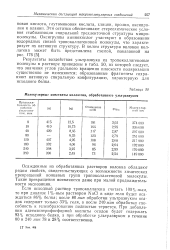 |
Молекулярные константы коллагена, обработанного ультразвуком. [23] |
Результаты воздействия ультразвука на тропоколлагеновые молекулы в растворе приведены в табл. 50, из которой следует, что значения углов удельного вращения плоскости поляризации существенно не изменяются; образованные фрагменты сохраняют нативную спиральную конфигурацию, характерную для исходного белка. [24]
Главные их недостатки - множественность и неравноценность точек разрыва. При гидролизе исходного белка это дает высокий фон, однако для дополнительного гидролиза уже очищенных пептидов указанные методы вполне пригодны. [25]
При кислотном гидролизе обработанного таким образом материала остатки аспарагино-вой кислоты дают лактон гомосерина, а остатки глутаминовой кислоты появляются в виде а-амино-8 - оксивалерьяновой кислоты. Остатки глутамина и аспарагина, присутствующие в молекуле исходного белка, при гидролизе превращаются в соответствующие дикарбоновые кислоты. Один из способов определения С-концевых остатков основан на применении карбокси-пептидазы ( из сока поджелудочной железы), специфически отщепляющей С-концевую аминокислоту. Этот метод страдает рядом недостатков, один из которых состоит в том, что фермент может отщеплять наряду с С-концевой группой следующий за ней аминокислотный остаток. [26]
Кислотные альбуминаты, образующиеся при энергичном действии кислот на белки, нерастворимы в воде и в разбавленных растворах солей, но хорошо растворяются в щелочах и разбавленных кислотах. Кислотные альбуминаты связывают значительно большее количество щелочи, чем исходный белок. [27]
Кислотные альбуминаты, образующиеся при энергичном действии кислот на белки, нерастворимы в воде и разбавленных растворах солей, но хорошо растворимы в растворах щелочей и разбавленных кислотах. Кислотные альбуминаты связывают значительно большее количество щелочи, чем исходный белок. [28]
Кислотные альбуминаты, образующиеся при энергичном действии кислот на белки, нерастворимы в воде и в разбавленных растворах солей, но хорошо растворяются в щелочах и разбавленных кислотах. Кислотные альбуминаты связывают значительно большее количество щелочи, чем исходный белок. [29]
Если исходный раствор тропоколлагена считать 100 % - ным, то при диализе 1 % - ным раствором NaCl в виде геля будет осаждаться 86 % белка; после 80 мин обработки ультразвуком осадок содержит только 33 % геля, а после 240 мин обработки способность к гелеобразованию полностью теряется. При добавлении аденозинтрифосфорной кислоты осадок будет содержать 93 % исходного белка, а при обработке ультразвуком в течение 80 и 240 мин 78 и 28 % соответственно. [30]
Страницы: 1 2 3 4