Исходный белок
Cтраница 3
Сопоставление таких групп, полученных действием разных ферментов, позволяет составить полную аминокислотную последовательность исходного белка. [31]
 |
Анализ аминокислотной последовательности бетка, радиоактивно меченного по отдельным аминокислотам. [32] |
Особые задачи возникают при исследовании первичной структуры сверхкрупных белков ( молекулярная масса более 100 000), поскольку с ростом молекулярной массы все сложности увеличиваются в геометрической прогрессии. Одии из возможных подходов в этом случае заключается в использовании ограниченного протес л и за для расщепления исходного белка на небольшое число фрагментов средней молекулярной массы ( 20 000 - 40 000) и в последующем исследовании фрагментов как отдельных белков. [33]
Хотя описан ряд методов селективного расщепления определенных пептидных связей белковой цепи на такие фрагменты, которые можно анализировать по методу Эдмана, широкое использование нашли всего несколько из них. Остаток метионииа превращается в гомосерин и его лактон, которые становятся С-концевыми остатками всех фрагментов, за исключением С-концевого фрагмента исходного белка. Так как Met встречается относительно редко, фрагменты, получающиеся после подобного расщепления, довольно крупны, но с помощью современных вариантов анализа по Эдману можно проводить анализ их последовательности. [34]
Микроколичества вещества обрабатывают в запаянных капиллярах, большие пробы материала гидро-лизуют на бане с применением обратного холодильника. При действии кислот или оснований в процессе гидролиза белков или пептидов имеют место в некоторых случаях потерн отдельных аминокислот, и, таким образом, содержание аминокислот в гидролизате не соответствует составу исходного белка или пептида. Поэтому для определения некоторых аминокислот применяют не соляную кислоту, а другие гидролизующие агенты. [35]
Многочисленные наблюдения показывают, что денатурация обратима. Многие белки, такие, как гемоглобин, сывороточный альбумин, трипсин и химотрипсин, денатурированные и затем сохраняемые в растворе при низкой температуре, вновь приобретают ( иногда после удаления денатурирующего агента) все свойства исходного белка, а именно растворимость, спектр, склонность к кристаллизации, маскирование некоторых групп SH и S-S и ферментативную активность. [36]
Поскольку только Е - фрагмент имеет W-концевой Val и только Н - фрагмент имеет концевой Leu, ясно, что эти пептиды являются концевыми фрагментами исходного белка. Порядок расположения F и G в исходном белке на этой стадии исследования структуры определить невозможно, и тогда структуру этого белка можно представить формулой E ( F, G) H, где запятая и скобки означают, что порядок связи заключенных в них фрагментов неизвестен. Предположим, что исходный белок можно расщепить другим способом на четыре других фрагмента W, X, Y, Z, с показанной структурой. [37]
Им это было необходимо для диссоциации крупных ( до М 10е) агрегатов а-кристаллина. На рис. 131 показано разделение исходного белка на 4 субъединицы. [38]
Для того чтобы определить число концевых групп на 1 моль белка, необходимо точно знать содержание белка в ДНФ-производ-ном. Воздушно-сухие ДНФ-белки обычно содержат около 70 % белка, но нужно получить точные данные на основании аминокислотного анализа или определения амидного азота. Последнюю величину можно просто и быстро определить для ДНФ-белка и исходного белка при помощи метода, описанного на стр. Другой возможный путь состоит в сравнении содержания трех или четырех различных аминокислот. [39]
Реакции замещения функциональных групп белка должны обязательно привести к изменению его физических свойств ( в первую очередь растворимости и электрохимического поведения), однако биологическая активность белка при этом иногда сохраняется. Херриотт подчеркивает, что при сравнении производного белка с его нативной формой желательно пользоваться рядом критериев. По его мнению, наилучшее доказательство того, что изменение белка обусловлено химической реакцией, а не денатурацией, будет получено в том случае, если удастся показать возможность регенерации свойств исходного белка. Таким образом, имеется ряд критериев для суждения о том, подвергся ли белок денатурации при химическом его изменении. Необходимо отметить, что сохранение активности белка после химической модификации часто является относительным; например кристаллический аце-тилированный пепсин обладает только 60 % протеолитической активности исходного фермента, причем фазовые диаграммы растворимости указывают на присутствие нескольких производных. [40]
 |
Каталитическое действие эмульсии бензальдегида на конденсацию продуктов гидролиза белка ферментами. [41] |
Эти предположения экспериментально проверили Уэйстнис и Борсук [ 68а ], которые нашли, что в пепсиновом гидролизате белка в присутствии концентрированного раствора пепсина и капелек эмульсии бензола и бензальдегида в заметной степени синтезируется сложное и менее растворимое вещество. Как показано на рис. 24, в отсутствие капелек масла реакция идет значительно медленнее. Эмульсии жиров каталитически не действуют, а ксилол, тальк, кизельгур и сульфат бария очень мало увеличивают скорость реакции. Если исходный белок деградировал незначительно, то выход при синтезе не зависит от наличия катализатора. [42]
 |
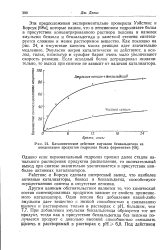
Схема прибора Тизелиуса для электрофоретического анализа белков. [43] |
Предположим, что мы имеем белковый раствор, в котором имеются три фракции, различающиеся между собой электрофоретическими скоростями и, и и и, причем электрофоретическая скорость и имеет наибольшую величину, а и наименьшую. На схеме рис. 82 эти фракции обозначены соответственно черными и белыми кружками. Фракция промежуточной скорости и обозначена наполовину зачерненным кружком. После удаления избытка исходного белка и заполнения верхней части трубки буферным раствором ( рис. 82, а) прибор устанавливается в исходное положение ( рис. 82, б) и включается электрическое поле. Направление поля таково, что частицы белков, имеющих одинаковый знак заряда, но различную скорость смещения, передвигаются слева направо. [44]
 |
Схема прибора Тизелиуса для электрофоретического анализа белков. [45] |
Страницы: 1 2 3 4