Отдельные белок
Cтраница 3
Естественно возник вопрос, чем же отличаются белки животные от белков растительных и какая разница между белками различных частей животного и растительного организмов. Для ответа на этот вопрос понадобилось прежде всего глубоко изучить химический состав отдельных белков. Необходимо было найти то общее, что встречается во всех белках независимо от их происхождения и что является характерным для белков, несмотря на их разнообразие. [31]
Всего в настоящее время открыто и выделено более 30 разнообразных аминокислотных групп. В каждую з них входит большое число индивидуальных аминокислот, из различных комбинаций которых состоят отдельные белки. [32]
Всего в настоящее время открыто и выделено более 30 разнообразных аминокислотных групп. В каждую из них входит большое число индивидуальных аминокислот, из различных комбинаций которых состоят отдельные белки. [33]
Со времени зарождения белковой химии принято деление глобулярных белков иа альбумины, глобулины, гистоиы, проламииы, протамииы, глу-телииы. Оно основано иа более или менее выраженных различиях в растворимости, распределении зарядов и аминокислотном составе отдельных белков. [34]
Следует отметить, что, хотя биосинтез белка, представляющий сложный многоступенчатый процесс, подробно описан во многих обзорах и монографиях, наши знания о структурно-функциональных взаимоотношениях многих его этапов все еще недостаточны. РНК; более того, выяснена аминокислотная последовательность всех 55 белковых молекул, первичная и вторичная структура 3 типов РНК, интенсивно изучается трехмерная структура отдельных белков рибосом прокариот. Тем не менее многие существенные детали механизма белкового синтеза неясны. Например, недостаточно известно, какие участки или составные части рибосом ответственны за инициацию, элонгацию и терминацию белкового синтеза; каков молекулярный механизм процессов транслокации, пептидилтранс-феразной реакции; каковы тонкие взаимодействия рибосом с белковыми факторами, мРНК, тРНК и антибиотиками. Потребуется еще немало усилий для определения полной молекулярной архитектуры рибосом и отдельных ее субчастиц, а также для выяснения и получения точных данных об их третичной структуре, форме и размерах, достаточных для раскрытия на молекулярном уровне функций рибосомы в сложном процессе синтеза белка. [35]
 |
Кристаллы цистина в осадке мочи ( под микроскопом. [36] |
Начиная с 1901 г., когда Эмилю Фишеру удалось впервые разделить гидролизаты белков путем перегонки в вакууме зфиров аминокислот, целым рядом работ было установлено, какие именно аминокислоты и в каком соотношении входят в состав отдельных белков. Когда был открыт способ образования пептидов, некоторые ученые полагали, что решение задачи синтеза белка - вопрос ближайшего будущего. И действительно, Абдергальдену и его ученикам удалось в 1916 г. получить полипептид, в состав которого входило 19 остатков отдельных аминокислот. [37]
 |
Кристаллы цистина в осадке мочи ( под микроскопом. [38] |
Начиная с 1901 г., когда Эмилю Фишеру удалось впервые разделить гидролизаты белков путем перегонки в вакууме эфиров аминокислот, целым рядом работ было установлено, какие именно аминокислоты и в каком соотношении входят в состав отдельных белков. Когда был открыт способ образования пептидов, некоторые ученые полагали, что решение задачи синтеза белка - вопрос ближайшего будущего. И действительно, Абдергальдену и его ученикам удалось в 1916 г. получить полипептид, в состав которого входило 19 остатков отдельных аминокислот. [39]
 |
Анализ аминокислотной последовательности бетка, радиоактивно меченного по отдельным аминокислотам. [40] |
Особые задачи возникают при исследовании первичной структуры сверхкрупных белков ( молекулярная масса более 100 000), поскольку с ростом молекулярной массы все сложности увеличиваются в геометрической прогрессии. Одии из возможных подходов в этом случае заключается в использовании ограниченного протес л и за для расщепления исходного белка на небольшое число фрагментов средней молекулярной массы ( 20 000 - 40 000) и в последующем исследовании фрагментов как отдельных белков. [41]
Как известно, молекулы белков построены из сотен аминокислотных остатков, примерно 20 различных типов. Их структура очень сложна, молекулярный вес огромен. Отдельные белки сильно отличаются друг от друга и также отличается характер действия на них отдельных протеиназ. Понятно, что ферментативный протеолиз в целом представляет собой чрезвычайно сложное явление. [42]
При этом они набухают, увеличивается их масса и объем. Набухание белка сопровождается его частичным растворением. Гидрофильность отдельных белков зависит от их строения. Имеющиеся в составе и расположенные на поверхности белковой макромолекулы гидрофильные - СО-NH - ( пептидная связь), аминные - NH2 и карбоксильные - СООН группы притягивают к себе молекулы воды, строго ориентируя их на поверхности молекулы. [43]
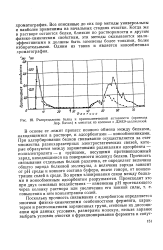 |
Распределение белка и протеолитической активности ( протеаза Asp. flavus в элюатах из колонки с ДЭАЭ-целлюлозой. [44] |
В основе ее лежит процесс ионного обмена между белками, находящимися в растворе, и адсорбентами - ионообменниками. При адсорбировании белков связывание осуществляется за счет множества разнохарактерных электростатических связей, которые образуются между заряженными радикалами адсорбента - лолиэлектролита - и группами, несущими противоположный заряд, находящимися на поверхности молекул белков. Прочность связывания отдельных белков различна, ее определяет величина общего заряда белковой молекулы, а величина заряда зависит от рН среды и ионного состава буфера, иначе говоря, от концентрации солей в среде. Во время элюирования связи между белками и ионообменным адсорбентом разрушаются. [45]
Страницы: 1 2 3 4