Равновесная жидкость
Cтраница 4
Производная, стоящая в левой части этого уравнении, определяет направление хода изотермы-изобары в каждой точке, если изотерма-изобара построена при использовании в качестве независимых переменных концентраций компонентов в паре и если для каждой точки известен состав равновесной жидкости. Рассчитанные по уравнению ( V-61) направления хода изотерм-изобар представляются на треугольной диаграмме для каждой точки пара в виде отрезков прямых, являющихся касательными к изотермам-изобарам в рассматриваемых точках. Эти отрезки касательных, взятые в совокупности, характеризуют расположение изотерм-изобар на диаграмме равновесия, построенной в переменных, выражающих состав пара. Найденные расчетным путем направления хода изотерм-изобар могут быть сопоставлены с изотермами-изобарами, определенными экспериментально по температурам кипения смесей. Необходимо отметить, что этот способ оценки надежности опытных данных может быть применен для обработки данных о равновесии как при постоянной температуре, гак и при постоянном давлении, поскольку независимо от условий экспериментального исследования равновесия каждая точка может рассматриваться как принадлежащая некоторой изотерме-изобаре. [46]
Строгое решение вопроса о зависимости состава тройного азеотропа от температуры было дано Сторонкиным и Морачев-ским [78], показавшими, что направление изменения состава тройного азеотропа с температурой зависит не только от парциальных молярных теплот испарения компонентов, как это имеет место для бинарных систем, но также от характера зависимости между составами равновесных жидкости и пара. [47]
Строгое решение вопроса о зависимости состава тройного азеотроша от температуры было дано Сгороикиным и Морачев-ск м [78], показавшими, что направление изменения состава тройного азеотропа с температурой зависит не только от парциальных молярных теплот испарения компонентов, как это имеет место для бинарных систем, но также от характера зависимости между составами равновесных жидкости и пара. [48]
 |
Диаграмма состояния трехком-понентной системы, в которой одна двухкомпонентная система показывает ликвацию. [49] |
Из тройной диаграммы ( рис. 20) видно, что добавление третьего компонента С постепенно сужает область ликвации adb, примыкающую к стороне АВ, и в критической точке d составы двух слоев жидкости совпадают. Составы равновесных жидкостей указываются концами экспериментально наносимых коннод, которые лежат на кривой границы области ликвации. [50]
В случае равновесия жидкость - пар, когда Si2 Ф 0, справедливо также обратное заключение. Если составы равновесных жидкости и пара оказываются одинаковы, то температура кипения при постоянном давлении имеет экстремум или стационарную точку. [51]
V, Н или S для равновесной жидкости в область Т Tg приводит к тому, что в некотором интервале достаточно низких температур, О Т Tg, указанные термодинамические характеристики жидкости становятся меньшими, чем в кристалле [ 69, с. [52]
С помощью выражения для энтропии идеального газа ычислить частные производные ( dS / dU) v и ( д8 / дУ) и. Отметим, что получающиеся соотношения справедливы для равновесных жидкостей и газов любой природы, а не только для идеального газа. [53]
 |
Дериватограмма нагрева серы.| Термодинамические характеристики парообразной серы. [54] |
При 159 4 С скачкообразно происходит полимеризация молекул серы. При дальнейшем повышении температуры содержание полимера в равновесной жидкости постепенно увеличивается. [55]
 |
Прибор Отмера. [56] |
Работа заключается в нахождении состава паровой фазы равновесной жидкости определенного состава и сравнении полученных данных со справочными. [57]
Дистилляцией называется процесс разделения раствора на те или иные составные части путем перегонки. В основе этого метода лежит различие в составах равновесных жидкостей и пара. [58]
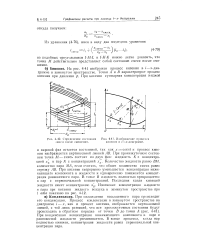 |
Определение состояния [ IMAGE ] - 41. Изображение процесса смеси после смешения. кипения в г-л - диаграмме. [59] |
При охлаждении насыщенного пара происходит его конденсация. При конденсации концентрация нижекипящего компонента в паре и равновесной жидкости увеличивается. В конце процесса, когда пар полностью ожижен, концентрация жидкости равна первоначальной концентрации пара. [60]
Страницы: 1 2 3 4