Неравноценность - атом
Cтраница 1
Неравноценность атомов водорода в молекуле органического вещества проявляется при водородном обмене с жидким бромистым дейтерием в гораздо большей степени, чем при обмене с жидким дейтероаммиаком, катализируемым амидом калия. [1]
Неравноценность атомов водорода в молекуле органического вещества проявляется при водородном обмене с жидким бромистым дейтерием в гораздо большей степени, чем при обмене с жидким дейтероаммиаком, катализируемым амидом калия. Используя различие скоростей обмена неравноценных атомов водорода, удается приготовить вещества, в которых часть атомов водорода в определенных положениях замещена на атомы дейтерия. Например, после того как в молекуле дифенила обменялось шесть атомов водорода, дальнейший обмен не наблюдается даже в течение 300 час. Аналогично, в и-терфениле замещается 10 атомов водорода. [2]
Сильная неравноценность атомов Н в молекуле анизола следует из вида кинетической кривой. [3]
Масштаб подобной кинетической неравноценности атомов брома, входящих в состав иона [ PtNH3Brs ] -, совместим с установленным на опыте при коротких временах обмена характером зависимости степени обмена от времени. [4]
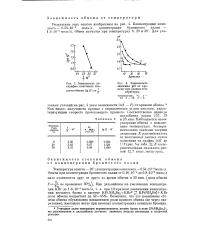 |
Зависимость логарифма константы ско.| Зависимость значения рН от времени при разных температурах. [5] |
Учитывая далее описанную неравноценность атомов брома в ионе [ PtNHaBrs ] -, мы рассчитываем в дальнейшем уточнить значения энергии активации и скоростей реакции. [6]
Равноценность или неравноценность атомов в молекуле определяется обычно исходя из структуры молекулы, которая, в свою очередь, устанавливается с помощью рентгеноструктурного или электронографического анализов. Такие способы могут быть использованы в отношении большинства молекул. Однако обработка полученных данных часто требует значительной затраты времени. Применение радиоактивных индикаторов дает два простых, хотя и не всегда применимых метода решения этой задачи. [7]
Весьма убедительно была доказана неравноценность атомов серы в тиосульфате. Вначале был проведен синтез 80з - S - 8 80з -, в результате которого был получен тиосульфат, меченый радиоактивной серой. При разложении тиосульфата S SOf - 2Н - SO2 S H2O выяснилось, что вся радиоактивность осталась в элементарной сере; переход радиоактивности в сульфитную серу йе был обнаружен. [8]
Весьма убедительно была доказана неравноценность атомов серы в тиосульфате. Вначале был проведен синтез 80з - S - - 8 8Оз -, в результате которого был получен тиосульфат, меченый радиоактивной серой. При разложении тиосульфата S SOf - 2Н - SO2 S H2O выяснилось, что вся радиоактивность осталась в элементарной сере; переход радиоактивности в сульфитную серу йе был обнаружен. [9]
Необычная степень окисления обусловлена структурной неравноценностью атомов азота в этом веществе. [10]
Томпсон [ Т6 ] показал неравноценность атомов железа в следующих комплексных соединениях: феррицианиде железа ( III) ( води. Эти соединения были синтезированы путем смешения растворов неактивного хлорида железа ( II) или железа ( III) с раствором соответствующего активного ферро - или феррицианидного комплекса. Полученные соединения разлагали щелочью, причем не входящее в комплекс железо осаждалось в виде гидроокиси, а цианидный комплекс оставался в растворе. [11]
Делают выводы о равноценности или неравноценности атомов свинца в Pb2O3 и записывают его структурную формулу. [12]
 |
Строение диборана. [13] |
В ( СН3) з неравноценности атомов водорода в В2Н6 свидетельствуют и результаты изучения ее ядерного магнитного резонанса. [14]
Поэтому каждый последующий гомолог из-за неравноценности атомов углерода дает несколько радикалов. При отнятии водорода от любого из двух первичных атомов углерода пропана получают радикал н-пропил ( нормальный пропил), а от вторичного атома углерода - радикал изопропил. Бутан и изобутан каждый образуют по два радикала. Буква н ( нормальный) перед названием радикала указывает, что свободная валентность находится на конце неразветвленной цепи. Приставка втор ( вторичный) означает, ч - fo свободная валентность находится у вторичного атома углерода, а приставка трет ( третичный) - у третичного. [15]
Страницы: 1 2 3 4