Неравноценность - атом
Cтраница 2
На примере трех изомеров пентана видна неравноценность атомов углерода, которые различаются по числу связей С-С. В изомере 2 появляется третичный, а в изомере 3 -четвертичный атомы углерода. [16]
Это обстоятельство со всей определенностью указывает на неравноценность атомов азота в азоксигруппе-вопрос, еще недавно бывший предметом оживленной дискуссии. Поскольку в соединении VII отсутствует, а в соединении VIII имеется необходимое для возникновения полярного сопряжения чередование связей, понятно, почему основности соединений VII коррелируются а, а соединений VIII-о - константами. [17]
Однако в последнее время [65] были получены указания на неравноценность атомов фтора. [18]
Комплекс с водой в отсутствие дополнительных поляризующих факторов устойчив и, несмотря на неравноценность атомов водорода ( заряды 0 37 и 0 26, порядки связей с кислородом 0 41 и 0 57 соответственно), отрыв одного из них в виде протона невыгоден. Для комплекса со спиртом ( RiOH) энергетически выгодным оказывается удаление катиона RJ, что приводит к электрофильному центру вида R ( OHA1RC12) - в полярных и R 6 ( OHA1RC12) - 5 в неполярных средах. Отсюда стадия инициирования, связанная с присоединением протона, для таких комплексов должна отсутствовать, но появляется возможность инициирования карбка-тионом. [19]
Полученные данные по трео-эритроизомеризации говорят за структуру ХХПб, так как только в ней возможна неравноценность атомов водорода относительно дикетофрагмента. [20]
Что касается мочевины, то формула ( 3) до известной степени объясняет ее однокислотность неравноценностью атомов азота; однако формула ( 4) кажется более вероятной, если принять во внимание получение мочевины действием фосгена на аммиак. [21]
В этом соединении степень окисления азота равна - / з - Необычная степень окисления обусловлена структурной неравноценностью атомов азота в этом веществе. [22]
Определяют, в каком веществе сосредоточена радиоактивная сера, и делают заключение о строении тиосульфата и равноценности или неравноценности атомов серы в нем. [23]
 |
Изменение степени обмена со временем. [24] |
Если на практике встречаются случаи, когда указанная зависимость не проходит через начало координат ( прямые 2 и 5), это означает, что исследуемый случай обмена осложнен каталитическими процессами либо указывает на неравноценность обменивающихся атомов в одном или в обоих из обменивающихся соединений. [25]
После подсчета молекулярного веса, составления предположительных структурных формул и наблюдения реакции спирта с натрием учитель ставит вопрос: Нельзя ли по количеству выделяющегося водорода сделать предположение о том, какая формула отвечает спирту. Учащиеся выдвигают гипотезу о неравноценности атомов водорода. Рассматривается прибор для количественного проведения опыта. Начав опыт, учитель поручает лаборант или одному из учеников следить за реакцией и постепенно добавлять спирт в колбочку с натрием. Измерительная склянка медленно начинает наполняться водородом. [26]
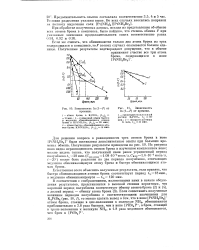 |
Зависимость In ( 1 - F от времени. [27] |
Для решения вопроса о равноценности трех атомов брома в ионв [ PlNH3Br3 ] - были поставлены дополнительные опыты при больших временах обмена. Из рисунка явно видна неравноценность атомов брома в изученном комплексном ионе; можно видеть также, что полученный нами ранее усредненный период полуобмена ft /, - 28 мин. [28]
В этом соединении степень окисления азота равна - 1 / а. Необычная степень окисления азота обусловлена структурной неравноценностью атомов азота в этом веществе. [29]
Эти формулы прежде всего показывают, что только в молекуле НС1 атом водорода непосредственно связан с атомом хлора, тогда как в молекулах НСЮ и НСЮ3 он соединен не с хлором, а с атомом кислорода. Кроме того, структурная формула хлорноватой кислоты указывает на неравноценность атомов кислорода; в ее молекуле каждый из двух атомов кислорода соединен с атомом хлора двумя валентными связями, а третий связан одновременно с атомами хлора и водорода. [30]
Страницы: 1 2 3 4