Неравноценность - связь
Cтраница 1
Неравноценность связей в соединении РЬ2О8 была доказана следующим образом: вначале был проведен синтез РЬ2О3 по схеме Na2PbO3 Na2Pb O2 2H2O - - Pb PbO3 4NaOH, затем при других концентрационных условиях это соединение разлагалось: Pb PbO3 4NaOH - Na2PbO3 Na2Pb O2 2H2O, в результате чего выяснилось, что вся радиоактивность осталась в плюмбите и-не перешла в плюмбат. [1]
Неравноценность связей в соединении РЬ2О8 была доказана следующим образом: вначале был проведен синтез РЬ2О3 по схеме Na2PbO3 Na2Pb O2 2H2O - Pb PbO3 4NaOH, затем при других концентрационных условиях это соединение разлагалось: Pb PbO3 4NaOH - Na2PbO3 Na2Pb O2 2H2O, в результате чего выяснилось, что вся радиоактивность осталась в плюмбите и-не перешла в плюмбат. [2]
Неравноценность связей могла бы быть установлена физ-ическими методами исследования, из которых важное значение имеет, например, определение энергии связей С-С, С С и СС. Как видно, при образовании второй связи между углеродными атомами общая энергия связи между двумя атомами не становится вдвое большей, а возрастает лишь на 61 2 ккал / моль; отсюда делается вывод, что я-связь слабее о-связи. [3]
Неравноценность связей могла бы быть установлена физическими методами исследования, из которых важное значение имеет, няпример, определение энергии связей С-С, С С и СС. Как видно, при образовании второй связи между углеродными атомами общая энергия связи между двумя атомами не становится вдвое большей, а возрастает лишь на 61 2 ккал / моль; отсюда делается вывод, что я-связь слабее 0-связи. [4]
Неравноценность связей в соединении РЬ2О8 была доказана следующим образом: вначале был проведен синтез РЬ2О3 по схеме Na2PbO3 Na2Pb O2 2H2O - Pb PbO3 4NaOH, затем при других концентрационных условиях это соединение разлагалось: Pb PbO3 4NaOH - Na2PbO3 Na2Pb O2 2H2O, в результате чего выяснилось, что вся радиоактивность осталась в плюмбите и-не перешла в плюмбат. [5]
Неравноценность связей Мо-О в Na2MoO4 2Н2О явно вызвана присутствием молекул воды: два атома О, находящиеся на наибольших расстояниях от Мо, образуют с молекулами воды водородные связи. [6]
Неравноценность связей Мо-О приводит, естественно, не только к линейным, но и к угловым искажениям координационных полиэдров. Величина и направления угловых искажений определяются в первую очередь стремлением атомов кислорода расположиться на равновесных расстояниях друг от друга. [7]
Обнаружена неравноценность связи как воды, так и оксалатных групп в изученных соединениях. На основании экспериментальных данных предложена общая формула соединений, отражающая неравноценность как связи воды, так и оксалатных групп. [8]
 |
Схема перекрывания 2 / - электронных облаков в молекуле N2. а-0 - связь. б и е - - я-связи. [9] |
Вывод о неравноценности связей в молекуле азота подтверждается тем, что энергия их разрыва различна. [10]
 |
Аррениусовские параметры термического распада молекул па два радикала в газовой фазе. [11] |
Кинетические проявления неравноценности связей С-С очевидны. [12]
Комплексным термогравиметрическим методом показана неравноценность связей соль - вода. [13]
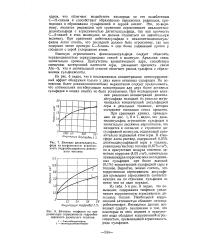 |
Влияние диоктилдисуль-фида на коррозионную агрессивность гидрообессеренного дизельного топлива.| Влияние тиофенов на коррозионную агрессивность гидрообессеренного дизельного топлива. [14] |
Высокую агрессивность фенилнонилсульфида следует объяснить неравноценностью серауглеродных связей в молекуле. Арильная связь значительно прочнее. Присутствие ароматического ядра, способствуя смещению электронной плотности серы, уменьшает прочность связи Alk-S, что в значительной степени облегчает распад сульфона с образованием сульфокислоты. [15]
Страницы: 1 2 3 4