Неравноценность - связь
Cтраница 2
Химические свойства нафталина также свидетельствуют о неравноценности связей в ядре. [16]
Недостатком такого изображения является локализация я-связи и обусловленная этим кажущаяся неравноценность связей С - О, что противоречит эксперименту. [17]
Иногда состав летучих продуктов может быть достаточно простым, что обычно наблюдается при резкой неравноценности связей в полимере. Так, при пиролизе в определенных условиях сополимеров стирола и метил-метакрилата продукты пиролиза состоят в основном из соответствующих мономеров. [18]
 |
Схема перекрывания 2р - электронных облаков в молекуле NJ. а - с-связы б и в-я-связи. [19] |
Но эти связи неравноценны: одна из них а-связь, а две другие я-связи, Вывод о неравноценности связей в молекуле азота подтверждается тем, что энергия их разрыва различна. [20]
Такое расщепление, как и в случае соединения II ( см. табл. 2), может быть объяснено либо неравноценностью связи групп, либо влиянием окружающего поля кристалла. [21]
Детальные структурные данные по последнему соединению показывают, по-видимому, что с неравноценностью расстояний Мо - Сс5н5 генетически связана и неравноценность связей С-С в самом кольце. [22]
Состав продуктов пиролиза, полученных в определенных условиях ПГХ, может быть достаточно простым, что обычно наблюдается в случае резкой неравноценности связей в сополимерах. Однако чаще при термической деструкции макромолекул происходит неупорядоченный разрыв химических связей с образованием сложной смеси летучих продуктов, отражающих как строение основной цепи, так и отдельных фрагментов исходных молекул. В то же время в каждом конкретном случае в зависимости от поставленной аналитической задачи хромато-графический опыт упрощается за счет того, что определяемые характеристики исследуемого образца связаны лишь с некоторыми компонентами в продуктах пиролиза. Эти компоненты, непосредственно отвечающие за состав, структуру или другие свойства образца и наилучшим образом отражающие определяемые характеристики, называют характеристическими продуктами пиролиза, а соответствующие этим соединениям пики на пирограмме - характеристическими пиками. [23]
 |
Длины связей в нафталине. [24] |
Если принять во внимание, что удельный вес структуры ( I) больше удельного веса других структур, то следует ожидать еще большей неравноценности связей. Рентгенографическое определение длин связей должно было бы показать, что связи 1 - 2, 3 - 4, 5 - 6 и 7 - 8 короче других. [25]
Еще в работе [18] Б. П. Никольский предположил, что более растянутый переход стеклянных электродов от водородной к металлической функции, чем это следует из простой теории, можно объяснить наличием неравноценности связей ионов в стекле. По мере повышения рН раствора происходит сначала замещение менее прочно связанных Н в электродном стекле на Ме из раствора, а потом - более прочно связанных. [26]
Если радиоактивные атомы изотопным обменом вводятся в соединение, содержащее несколько атомов, способных к обмену, то происходит равномерная пометка во всех положениях при равноценности связи атомов в молекуле и неравномерная по удельной активноти пометка в случае неравноценности связи атомов в молекуле. Метод изотопного обмена обычно не позволяет производить пометку в строго фиксированном положении, что является его недостатком. [27]
Такое предположение может объяснить, почему двойная связь легко присоединяет только два, а тройная - только четыре эквивалента. Неравноценность связей может быть подтверждена физическими методами исследования, из которых, пожалуй, наибольшее значение имеет определение энергии связей С-С, СС и С С. Значения энергии этих связей составляют соответственно 62 77; 101 16; 128 15 ккал / моль. Как видно, при образовании второй связи между углеродными атомами общая энергия связи между двумя атомами не становится вдвое большей, а возрастает лишь на 38 39 ккал / моль; отсюда делается вывод, что я-связь слабее з-связи. [28]
Если использовать схему Шлемпера [145], то следует принять, что в последней структуре атом Sn находится в состоянии sp3 - rn - бридизации и образует нормальные ковалентные связи с метальными группами и атомом С1 и трехцентровую связь с дитиокарбаматным лигандом. Однако неравноценность связей Sn-S и величины валентных углов при Sn приводят авторов [142] к заключению, что комплекс все же лучше описывается как тригонально-бипирамидальный, а не тетраэдри-ческий. [29]
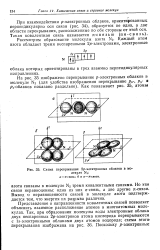 |
Схема перекрывания 2р - электронных облаков в молекуле N2. а - а-связь. б и в-л-связи. [30] |
Страницы: 1 2 3 4