Неравноценность - связь
Cтраница 4
Как показывает рис. 35, атомы азота связаны в молекуле N2 тремя ковалентными связями. Но эти связи неравноценны: одна из них а-связь, а две другие я-связн. Вывод о неравноценности связей в молекуле азота подтверждается тем, что энергия их разрыва различна. [46]
Другие аналогичные примеры можно найти среди молибдатов и воль-фраматов, в частности, в тех из них, которые содержат одновременно атомы щелочных или щелочноземельных и переходных металлов. Наконец, в Na2Mo04 - 2Н20 неравноценность связей Мо-О явно вызывается тем, что два из четырех атомов кислорода аниона [ Мо04Р - образуют водородные связи с молекулами воды. Именно эти два кислорода находятся от молибдена на небольших расстояниях. [47]
Основываясь на вычисленных значениях электростатической, ковалентной, а также резонансной энергии, последняя из которых обусловлена делокализацией валентных штрихов, Я. К. Сыркин пришел к выводу, что в этом ионе все связи Pt - С1 равноценны и в значительной степени ковалентны. Равноценность энергий связи и ковалентного состояния нарушается лишь при замене хлора другим лигандом. Вернера должна быть дополнена рассмотрением наличия неравноценности связей вокруг центрального атома. Так как центральный атом платины имеет два электрона ( s и d), способных принять участие в ковалентных связях, то, по мнению Я. К. Сыркина, имеется возможность образования sd - гибридизации их орбиталей. Надо иметь в виду - писал он - что при этом возникают две ковалент-ные связи с наибольшим перекрыванием электронных облаков под углом 90градусов [ 221, стр. [48]
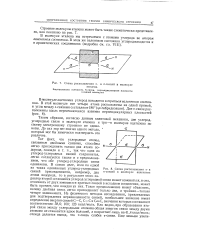 |
Схема расположения о - и те-связей в молекуле этилена.| Схема расположения о - и тс-связей в молекуле ацетилена. [49] |
В самом деле, если по одной из таких одинаковых углерод-углеродных связей присоединяются, например, два атома водорода, то в результате этого характер второй оставшейся углерод-углеродной связи может измениться, и она, отличаясь от двух имевшихся кратных связей в исходном соединении, может быть прочнее, чем каждая из них. Такое предположение может объяснить, почему двойная связь легко присоединяет только два, а тройная-только четыре эквивалента. Из физических методов исследования, привлекаемых для подтверждения неравноценности связей, наибольшее значение имеет определение энергии связей С-С, СС и СйС, значения которых составляют соответственно 58 6; 100; 123 ккал / моль. Как видно, при образовании второй связи между углеродными атомами общая энергия связи между двумя атомами не становится вдвое большей, а возрастает лишь на 41 4ккал / моль; отсюда делается вывод, что тс-связь слабее а-связи. [50]
В ионе [ PtCl4 ] 2 - все связи Pt-О равноценны и в значительной степени ковалентны. Равноценность энергий связи и ковалентного состояния нарушается при замене хлора другим лигандом. Сыркин считал, что в явлении трансвлияния необходимо рассматривать неравноценность связей вокруг центрального атома. Так как центральный атом платины имеет два электрона ( s и d), способных принять участие в ковалентных связях, то, по мнению Сыркина, имеется возможность sd - гибридизации их орбиталей. [51]
Второй важной особенностью нафталина является неравноценность его ароматических связей. В то время как в бензоле и его производных все связи кольца имеют одинаковый порядок, в нафталине выравненность связей нарушена: связи 1 - 2, 3 - 4, 5 - 6, и 7 - 8 имеют более высокий порядок, более непредельны, а связи 2 - 3 и 6 - 7 - более низкий порядок, чем связи бензола. Это показано измерением межатомных расстояний и квантовохимическим расчетом. Неравноценность связей нафталина проявляется во многих особенностях его реакционной способности. [52]
Страницы: 1 2 3 4