Sd-подуровень
Cтраница 3
 |
Заполнение электронами внешних подуровней атомов элементов с Z, равным 18, 19, 20 и 21. [31] |
Начиная с 19-го элемента - калия, несмотря на то что в еп атоме Sd-подуровень остается вакантным, последний электрод занимает 45-подуровень. [32]
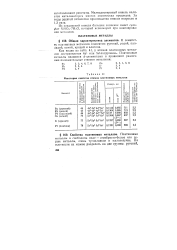 |
Некоторые свойства атомов платиновых металлов. [33] |
Как видно из табл. 41, у атомов платиновых металлов достраивается 4d - или Sd-подуровень. [34]
Поглощение световой энергии той или иной длин ы волны приводит к возбуждению электронов недостроенного и поэтому подвижного Sd-подуровня, они повышают свою энергию, а мы воспринимаем поглощение света той или иной волны как окрашенность соединения. [35]
У следующего за гадолинием элемента тербия вновь сохраняется верным правило ( п l) и электроны один с Sd-подуровня и один новый, дополнительный, вступают на 4 / - подуровень. [36]
В атомах элементов от гафния Ш ( порядковый номер 72) до ртути Hg ( порядковый номер 80) продолжается заполнение пятого энергетического уровня ( Sd-подуровня), после чего у элементов от таллия Т1 ( порядковый номер 81) до радона Rn ( порядковый номер 86) электроны заполняют шестой р-подуровень. Элементом радоном Rn заканчивается 6 - й период. В нем - тридцать два элемента. [37]
Последовательность энергетических подуровней соблюдается при заполнении рядом стоящих в ней подуровней; например, в атомах калия, кальция и скандия 45-подуровень ниже по энергии, чем Sd-подуровень, но в атомах более тяжелых элементов последовательность этих подуровней иная. Заряд ядра и заселенность других орбиталей сильно влияют на энергию конкретной орбитали ( см. разд. Можно утверждать, что последовательность энергетических подуровней ( см. рис. 2.11) справедлива только для валентных подуровней; так, неравенство 5р d оказывается верным для иттрия, но не для всех элементов. [38]
Благодаря этому один из 4 / - электранов ( а в некоторых случаях, например, у церия, два 4 / - электрона) легко возбуждается, переходя на Sd-подуровень, и становится, таким образом, валентным электроном. Это обстоятельство объясняет близость свойств лантаноидов к свойствам элементов подгруппы скандия. [39]
Благодаря этому один из 4 / - электронов ( а в некоторых случаях, например, у церия, два 4 / - электрона) легко возбуждается, переходя на Sd-подуровень, и становится, таким образом, валентным электроном. Это обстоятельство объясняет близость свойств лантаноидов к свойствам элементов подгруппы скандия. [40]
У лантана согласно правилу ( п l) электрон должен находиться на 4 / - подуровне, однако, вопреки этому, из-за очень близких энергий 4f - и Sd-под-уровней и из-за особой устойчивости незаполненного 4 / - подуровня электрон вступает на Sd-подуровень. [41]
Электроны с s - и р-подуровней атома С. Sd-подуровень, при этом увеличивается число неспаренных электронов. [42]
Для электронного строения никеля ( 3d84s2) характерна близость к завершению Sd-подуровня. Это делает Sd-подуровень никеля ( 3d8) более стабильным, чем в случае кобальта ( 3d7) и особенно железа ( 3d6), Поэтому, хотя переход Ni / Ni2 характеризуется величиной Е0 0 23 В. Поэтому трехвалентное состояние никеля маловероятно: Ni ( III) должен, проявлять свойства сильнейшего окислителя и стабилизация его является трудной задачей. [43]
Такой же повышенной энергетической устойчивостью обладают и электронные конфигурации с ровно наполовину заполненным подуровнем. Этим объясняется провал одного 45-электрона в атоме хрома на Sd-подуровень, в результате которого атом хрома приобретает устойчивую электронную структуру Is22s22p63s23y063d84s1 с ровно наполовину заполненным 3d - подуровнем. Аналогичный провал Ss-электрона на 42-подуровень происходит и в атоме молибдена. Такие же провалы имеют место и в атомах ниобия, рутения, родия, палладия и платины. [44]
В атомах элементов шестого периода цезия ( Z55) и бария ( Z56) заполняется бх-подуровень. У лантана ( Z57) один электрон поступает на Sd-подуровень, после чего заполнение этого подуровня приостанавливается, а начинает заполняться 4 / - подуровень, семь орбиталей которого могут быть заняты 14 электронами. Поскольку у этих элементов заполняется глубинный 4 / - подуровень третьего снаружи уровня, они обладают весьма близкими химическими свойствами. С гафния ( Z72) возобновляется заполнение d - подуровня и заканчивается у ртути ( Z-80), после чего электроны заполняют б / 7-подуровень. [45]
Страницы: 1 2 3 4