Sd-элемент
Cтраница 3
Как известно, одна из важных закономерностей термохимии ненасыщенных соединений переходных металлов - двугорбая форма зависимости энтальпий атомн-зации, например, соединений типа МО, МС12 и др. от порядковых номеров ( в пределах серии Sd-элементов) - объяснялась многими авторами с позиций теории кристаллического поля на основе представления о так называемой экстрастабилизации, якобы имеющей место за счет расщепления rf - уровней в поле кристаллической решетки. [31]
Учесть, что для большинства d - элементов характерны следующие особенности: переменная валентность; повышение устойчивости высших валентных состояний по группе; склонность к образованию координационных связей; исключительная близость в свойствах 4d - и Sd-элементов одной и той же группы; аналогия в свойствах соседних d - элементов одного периода; высокие твердость и тугоплавкость металлов; понижение их химической активности по группе. [32]
Однако уже в области Sd-элементов начинаются пока еще непреодолимые препятствия к пониманию природы атомов, не говоря уже о молекулах и тем более о водных растворах. [33]
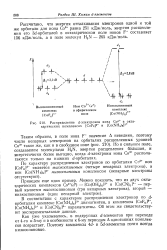 |
Распределение d - электронов иона Со3 1 в окта-эдрических комплексах [ СоРз ] 3 и [ Co ( NH3 el3. [34] |
Как уже указывалось, в подгруппах d - элементов при переходе от 4-го к 5-му и в особенности к 6-му периодам А однотипных комплексов возрастает. Поэтому комплексы 4d - и Sd-элементов почти всегда низкоспиновые. [35]
Гидроксид и оксид железа ( II) проявляют только основные свойства. Аналогичными свойствами обладают подобные гидроксиды и оксиды других Sd-элементов - хрома, марганца, кобальта и никеля. [36]
Дигалиды Мо и W в отличие от дигалидов Сг относятся к кластерным соединениям. Кластерные галиды характерны для 4d - и Sd-элементов V-VI11 групп, но не характерны для Зс. Характерная для 4d - и Sd-элементов тенденция к использованию при образовании химической связи всех своих валентных электронов обычно осуществляется за счет перехода их в высшую степень окисления. [37]
Мультиплетное расщепление обычно невелико - это позволяет использовать La-полосу переходных Sd-элементов даже при наличии неспаренных электронов для качественного исследования электронного строения; не следует, однако, использовать эту полосу без поправок на мультиплетное расщепление для количественных выводов. [38]
Ход истинной энергии связи, как это и видно из рис. 4, гораздо проще и, видимо, отражает идею о недостатке и избытке электронов. Теперь следует попытаться ответить на вопрос об аномальном поведении ранних Sd-элементов по сравнению с поздними. В этом отношении может быть следует обратить внимание на отмеченную Крегом [8] преимущественную способность Ti, V и Сг давать особенно заметный вклад в энергию за счет кратности связей. Обращаясь к ранее приведенной таблице интегралов перекрывания для 3djt и 2рп орбитальных облаков, мы начинаем понимать их значение для химии Ti, V и Сг; для Sc интеграл велик, но число d - электронов мало. В кристаллическом состоянии Ti и V могут упрочнять свои связи и за счет добавочных М - М перекрываний. [39]
В пределах одной и той же d - группы атомные радиусы элементов в целом растут. Однако этот рост меньше ожидаемого; более того, атомные радиусы Sd-элементов практически равны атомным радиусам их электронных аналогов - 4й - элементов. [40]
Сходство в химических свойствах оксидов Зр - и Sd-элементов еще больше: аналогичны формулы оксидов, соответствующих им гидроксидов, кислот и солей; с ростом порядковых номеров элементов кислотные и окислительные свойства быстро нарастают, а склонность к образованию полимеров уменьшается. Эти изменения происходят так, что аналогичные пары соединений Зр - и Sd-элементов имеют совпадающие или близкие качественные характеристики. [41]
ШЕСТОЙ самый длинный период - появляются 14 / - элементов - лантаноидов, обладающих низкой элетроотрицательностью и ярко выраженными металлическими свойствами и очень похожих друг на друга и на лантан. Заполнение 4 / - оболочки вызывает лантаноидное сжатие, приводящее к уменьшению радиусов атомов и ионов следующих за ними Sd-элементов по сравнению с 4й - элемен-тами пятого периода. В результате d - элементы третьего переходного ряда очень близки по свойствам к своим аналогам из второго переходного ряда. [42]
Способность к образованию комплексных соединений, свойственная всем переходным металлам, наиболее ярко проявляется у элементов VIIIB-группы, в частности у элементов триады железа. Помимо дефектности d - оболочки, здесь немаловажную роль играет то, что атомные и ионные радиусы Fe, Co, Ni наименьшие среди Sd-элементов, в силу чего увеличивается поляризующее действие и образуются более прочные связи с лигандами. [43]
 |
Модель структуры, предложенная для Na Pt3O4. [44] |
Оксиды такого состава характерны лишь для некоторых металлов, причем металл обязательно имеет две степени окисления. Структура РЬ3О4 описана далее в разд. Оксиды Sd-элементов состава МзО имеют структуру шпинели, которая описана в гл. О структуре Со3О4 более детально см. в разд. [45]
Страницы: 1 2 3 4