Нуклеофильность - анион
Cтраница 3
 |
Кинетические параметры, реакции ( 12, протекающей в жидкой SO 2 при О С. [31] |
С практической точки зрения ясно, что, увеличивая степень диссоциации реагента-нуклеофила, можно значительно увеличить скорость реакции или осуществить превращение, которое невозможно из-за пониженной нуклеофильности аниона в ионной паре. Наилучшие результаты дает введение в реакционную среду добавок, которые за счет сильной специфической сольватации катиона способствуют разъединению фрагментов ионной пары. Можно также снижать концентрацию, но эта операция, вызывая рост & Набл из-за увеличения доли более активных свободных анионов, приводит к уменьшению скорости процесса. Примером может служить [15] относительно простое замещение брома на фтор под действием 18-крауна - 6 ( I) в реакциях бензилбромида и бром-алканов с фторидом калия в ацетонитриле и бензоле. [32]
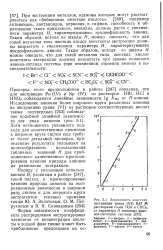 |
Зависимость констант экстракции урана ( VI 0 47 М растворами солей ТОА в СНС13 от параметра Н основных анио-нов-лигандов системы. [33] |
При экстракции металлов, катионы которых могут рассматриваться как обобщенные жесткие кислоты [249], например актиноидов, лантаноидов, циркония и гафния, способность к образованию таких комплексов, очевидно, должна расти с увеличением параметра Я, характеризующего нуклеофильность аниона. Таким образом, исходя из шкалы Я, можно ожидать, что для солей металлов типа жестких кислот константы экстракции должны возрастать с увеличением параметра Я, характеризующего нуклеофильность аниона. [34]
Основной причиной уменьшения нуклеофильности аниона в воде и спиртах является образование вокруг него сольватной оболочки, которая тем прочнее, чем лучшим акцептором является анион. Тем не менее прийти к такому выводу в ряде случаев невозможно, если пренебречь влиянием ионной ассоциации. Так, в реакции н-бутилброзилата ( X OBs) с галогенидами лития наблюдаемая константа скорости растет в ряду LiClLiBrLiI ( табл. 7.1), и только пересчет ее в kn с помощью уравнения Акри ставит все на свои места. [35]
Таким образом, значение Я аниона-лиганда в основном определяет тип зависимости DM & от концентрации соответствующей кислоты. Однако поскольку на собственную нуклеофильность аниона, входящего в состав соли амина, влияют также строение амина и сольватация электрофильными разбавителями, эти факторы также могут влиять на положение максимума зависимости D от [ А - ] водн - Поскольку изменения строения амина, приводящие к росту экстракционной способности его соли, связаны с ростом нуклеофильности аниона соли, то такие изменения приводят к сдвигу максимума экстракции влево; поскольку рост сольватации катиона соли амина также приводит к росту нуклеофильности аниона, то такое влияние также сдвигает влево указанный максимум. [36]
Реакционная способность иона в растворе тем больше, чем слабее связан он с молекулами растворителя и с противоионом. Оба эти фактора решающим образом влияют на нуклеофильность анионов по отношению к органическим субстратам. В мягких биполярных апротонных растворителях сольватация анионов, вообще незначительная, увеличивается в обратной последовательности с увеличением размера иона. В результате нуклеофильность аниона при переходе от протонного к биполярному апротонному растворителю возрастает, и тем больше, чем более жестким является анион. При сравнении для уменьшения влияния природы уходящей группы ( см. 2.5) в первом случае использовано вытеснение жесткого ( XF), а во втором мягкого ( Х1) основания. [37]
Стереохимическое течение нуклеофильного замещения определяется механизмом реакции ( 8x2, 5д - 1 или S i), который, как уже упоминалось ( разделы 5.1 и 5.3.1), часто зависит от природы растворителя. Протонные растворители в отличие от ди-полярных апротонн-ых понижают нуклеофильность анионов, но одновременно способствуют ионизации поляризованных связей. [38]
Во введении уже было сказано о том, что в присутствии противоположно заряженной частицы реакционная способность иона-реагента претерпевает изменения. В реакциях нуклеофильного замещения ассоциация с катионом всегда приводит к уменьшению нуклеофильности аниона. Однако то, как сильно снижается ну-клеофильность, зависит от конкретной реакции и условий ее проведения. [39]
Обрыв цепи может происходить в различной степени посредством соединения растущего оксониевого иона либо с противоио-ном, либо с анионной частью противоиона, что более вероятно. Так, выше было отмечено, что использование протонной кислоты в качестве катализатора лимитируется нуклеофильностью аниона кислоты. [40]
 |
Параметры нуклеофильности Я некоторых анионов. [41] |
Приведенные закономерности могут быть поняты более глубоко на основании полученных в последние годы сведений об экстракции кислот солями аминов, включающих анионы другой кислоты. В работах [41-43] показано, что при экстракции щавелевой кислоты и некоторых других органических кислот галогени-дами три-н-октиламина по реакции присоединения, рост нуклеофильности аниона, входящего в состав соли амина ( например, замена Вг - на С1 -) приводит к увеличению извлечения кислоты, находящейся в водном растворе. Это находится в соответствии с рассмотренными выше закономерностями влияния природы аниона на экстракцию кислот по реакциям присоединения. Из этого следует, что и при извлечении кислот одноименными солями аминов действуют одновременно два фактора: нуклеофильность анионов ( со стороны анионов, входящих в состав соли) и энергия гидратации этих же анионов ( со стороны анионов, извлекаемых из водной фазы); найденные корреляции от Я свидетельствуют о том, что при одновременном действии обоих факторов определяющее влияние на экстракцию кислот одноименными солями аминов оказывают изменения нуклеофильности анионов. [42]
Чтобы исключить возможность механизма элиминирования - присоединения, был исследован стереохимический ход реакции с азид-ионом цис - и / repawc-oc - метилзамещенных фенил-р-хлорвинилкетонов. Так как такие соединения значительно менее реакционноспособны, чем незамещенные при углероде двойной связи р-хлорвинилкетоны, то в качестве растворителя был использован ДФА, нуклеофильность анионов в котором резко возрастает. Фенил - ( а-метил-р-хлорвинил) кетон реагировал с N3 - ионом в ДФА очень легко, а из азотсодержащих продуктов был выделен в основном транс-фенил - ( а-метил-р-азидовинид) кетон. В качестве примеси был обнаружен 4-метил - 5-фенилизоксазол. В то же время ас-изомер реагировал в тех же условиях медленнее, и из реакционной смеси был выделен в основном 4-метил - 5-фенилизоксазол; в виде примеси был обнаружен тракс-фенил - ( а-метил - [ 3-азидовинил) кетон. Таким образом, несмотря на то, что механизм элиминирования - присоединения невозможен ( отсутствуют а - Н), продукты замещения получены из обоих изомеров и в основном с сохранением исходной геометрической конфигурации. Итак, к рассмотренному случаю, по-видимому, приложим механизм прямого нуклеофильного замещения. Данные кинетики, полученные недавно 1258а ], также подтверждают этот механизм. [43]
При экстракции металлов, катионы которых могут рассматриваться как обобщенные жесткие кислоты [249], например актиноидов, лантаноидов, циркония и гафния, способность к образованию таких комплексов, очевидно, должна расти с увеличением параметра Я, характеризующего нуклеофильность аниона. Таким образом, исходя из шкалы Я, можно ожидать, что для солей металлов типа жестких кислот константы экстракции должны возрастать с увеличением параметра Я, характеризующего нуклеофильность аниона. [44]
Таким образом, значение Я аниона-лиганда в основном определяет тип зависимости DM & от концентрации соответствующей кислоты. Однако поскольку на собственную нуклеофильность аниона, входящего в состав соли амина, влияют также строение амина и сольватация электрофильными разбавителями, эти факторы также могут влиять на положение максимума зависимости D от [ А - ] водн - Поскольку изменения строения амина, приводящие к росту экстракционной способности его соли, связаны с ростом нуклеофильности аниона соли, то такие изменения приводят к сдвигу максимума экстракции влево; поскольку рост сольватации катиона соли амина также приводит к росту нуклеофильности аниона, то такое влияние также сдвигает влево указанный максимум. [45]
Страницы: 1 2 3 4