Область - пассивация
Cтраница 3
Именно, при непрерывном изменении I полный ток изменяется скачком, если начальная поляризация лежит в области пассивации. В опытах Уилла [2] с полупогруженными платиновыми электродами наблюдались явления, которые, по-видимому, принадлежат к этой категории. [31]
С и склонной к межкри-сталлитной коррозии, при испытаниях в растворах серной кислоты с потенциалами, отвечающими началу области пассивации, разрушаются участки, расположенные по границам зерен. [32]
Из поляризационных кривых установлено, что наименьшая скорость растворения титана в пассивной области при рН - 9 - 11, но область пассивации незначительная. При рН 3 - 6 скорость коррозии несколько увеличивается, но границы устойчивого состояния потенциалов увеличиваются значительно. Это дает возможность работать в большем интервале потенциалов при незначительной скорости коррозии титана. [33]
Об изменении характера анодного процесса свидетельствует также существенное уменьшение емкости до 0 1 мкф / см и увеличение сопротивления электрода в области пассивации. Такой характер изменения емкости и сопротивления с ростом потенциала можно объяснить возникновением на электроде новых поверхностных соединений, которые приводят к дальнейшему изменению характера процесса. [34]
Как уже указывалось, аустенитная нержавеющая сталь 1Х18Н9Т может пассивироваться в растворах хлоридов; следовательно, с увеличением концентрации ионов хлора область пассивации уменьшается. На ферритных сталях XI7, XI8, содержащих практически такое же количество хрома, что и аустенитная нержавеющая сталь 1Х18Н9Т, это явление наблюдается еще в более сильной степени. Так, если в растворе ионов хлора концентрации 0 001 Н сталь 1Х18Н9Т имеет значительную область пассивации, то стали типа Х13, Х17уже при стационарных потенциалах в насыщенных воздухом растворах находятся в области перепассивации. Из изложенного видно, что для работы в растворах хлоридов следует применять сплавы, имеющие аустенитную кристаллическую решетку. [35]
Участок кривой, соответствующий области активного растворения, сдвинут параллельным переносом в сторону отрицательных значений потенциалов на величину до 70 мВ; область пассивации сократилась с 440 мВ для ненапряженного металла до 47 мВ; плотность критического тока пассивации увеличилась на порядок. [37]
Поскольку пассивность свинцового анода в сернокислом растворе наступает сразу же после включения тока, то для более точного выявления хода поляризационной кривой в области пассивации принимают следующую методику исследования. [38]
В смеси уксусной и муравьиной кислот анодные и катодные поляризационные кривые каждой из изученных сталей пересекаются в трех точках: активной области, области пассивации и пассивной области. Этим точкам пересечения должны соответствовать и значения стационарных потенциалов, то есть стационарные состояния металла. Для такой системы должны быть стабильны два состояния, соответствующие пересечению поляризационных кривых в активной либо пассивной областях. [39]
Учитывая, что степень запассивированности металла является функцией потенциала и пользуясь потенциостатической кривой, можно наметить некоторые пути регулирования скорости коррозионного процесса в области пассивации. [40]
В целом для этих металлов при анодном растворении в неводных средах, по данным поляризационных измерений, характерно чередование активных областей растворения с областями пассивации и перепассивации. [41]
Это, согласно ( 1 25), указывает на то, что поверхностные окислы, существующие на железе в области активного растворения и в области пассивации, обладают проводимостью преимущественно электронного типа и содержат избыточные против стехиометрии атомы железа. [42]
Если основа сплава склонна в данных условиях к пассивации, то, наоборот, более электрохимически положительный потенциал поверхностного слоя может смещать потенциал непокрытых участков в область пассивации и способствовать анодной электрохимической защите оголенных участков от коррозии. [43]
Противоречивость существующих представлений о механизме анодного пассивирования и природе пассивного состояния свидетельствует, по-видимому, не только о сложности самого явления, но и о недостаточности наших знаний об электрохимическом поведении металлов в области пассивации. Применявшиеся до последнего времени методы исследования, такие, как метод кривых заряжения и обычный метод поляризационных кривых, заключающийся в измерении потенциала металла при последовательном увеличении плотности анодного тока, недостаточно характеризуют это поведение. [44]
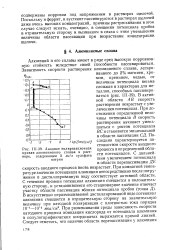 |
Анодная поляризационная кривая алюминиевого сплава в растворе, содержащем 5 мг / л сульфата натрия. [45] |
Страницы: 1 2 3 4 5
