Область - перепассивация
Cтраница 2
Е-2 металла располагается в области перепассивации. Различие заключается в том, что в первом случае снижение скорости растворения металла достигнуто без изменения характера его растворения - металл остался в активном состоянии. [16]
В активной области и области перепассивации скорость коррозии нержавеющих сталей возрастает с увеличением потенциала в соответствии с законом электрохимич. В неустойчивой области, наоборот, скорость коррозии нержавеющих сталей уменьшается с увеличением потенциала, что связано с постепенной пассивацией поверхности нержавеющих сталей. При достижении полной пассивации скорость коррозии нержавеющих сталей практически не зависит от потенциала. [18]
 |
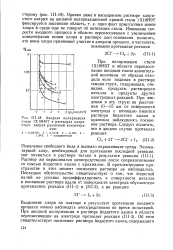
Влияние содержания хрома в стали на предельный ток в области вторичной пассивности в 2 н. хлорной кислоте. [19] |
При достаточно отрицательных потенциалах в области перепассивации хромистая сталь ( Х28) растворяется в серной кислоте с преимущественным переходом в раствор железа [99], что также находится в соответствии с электрохимическими свойствами индивидуальных металлов. [20]
 |
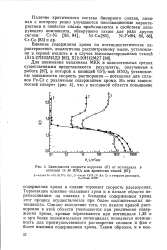
Анодная поляризация стали 1Х18Н9Т в растворах хлористого натрия различной концентрации. [21] |
При поляризации стали 1Х18Н9Т в области перепассивации анодным током значительной величины от образца отходила ясно видимая в растворе темная струя, содержащая, очевидно, продукты растворения металла и продукты других электродных реакций. [22]
Слабое разрушение по границам зерен в области перепассивации наблюдается у сталей, склонных к межкристаллитной коррозии. [23]
Некоторые преимущества Мо2С проявляются в начале области перепассивации благодаря тому, что процесс перепассивации осуществляется на нем с большим перенапряжением. Это может позволить использовать Мо2С с большей эффективностью, чем молибден в начале рассматриваемой области ( 0 - 0 15 в), где скорости растворения еще незначительны. Причина рассматриваемого эффекта, по-видимому, заключается в блокирующем действии обогащенных углеродом поверхностных слоев. По мере увеличения скорости растворения эти слои формируются менее плотными и их тормозящее воздействие уменьшается. Возможно, что определенную роль играет также снижение реакционной способности молибдена карбида за счет его связи с углеродом. [24]
 |
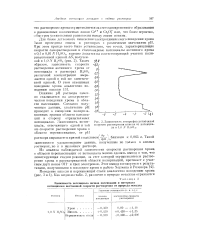
Зависимости скорости коррозии ( К от потенциала в кипящей 14 М HNO3 для хромистых сталей. [25] |
Тормозящее влияние оказывает хром и в начале области перепассивации: на сплавах с большим содержанием хрома этот процесс осуществляется при более положительных потенциалах. Однако вследствие того, что наклон кривой растворения в этой области уменьшается при увеличении содержания хрома, кривые пересекаются при потенциале 1 35 в и при более положительных потенциалах появляется возможность для преимущественного растворения сплавов и фаз с более высоким содержанием хрома. [26]
 |
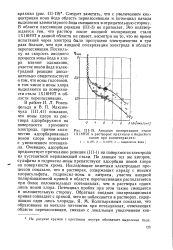
Зависимость логарифма устойчивой скорости растворения никеля от потенциала в 1 0 Л 1J2S04. [27] |
Из анализа наблюдаемой зависимости скорости растворения хрома в области перепассивации от потенциала можно сделать вывод о том, что лимитирующая стадия реакции, за счет которой осуществляется растворение хрома в рассматриваемой области поляризаций, протекает с участием двух ионов ОН - и трех электронов. [28]
 |
Анодная поляризация стали 1Х18Н9Т в растворах крахмала и йодистого. [29] |
Следует заметить, что с увеличением концентрации иона йода область перепассивации и потенциал начала выделения элементарного йода смещаются в отрицательную сторону. В области пассивации реакция ( II1 - 3) не протекает. Это подтверждается тем, что раствор после анодной поляризации стали 1Х18Н9Т в данной области не синеет, несмотря на то, что во время испытаний через электрод было пропущено электричества в три раза больше, чем при анодной поляризации электрода в области перепассивации. Поскольку на скорость анодного процесса ионы йода и хлора влияют одинаково, участие ионОв йода в электродной реакции дополнительно свидетельствует о том, что ионы галогенов, в том числе и ионы хлора выделяются на поверхности стали 1Х18Н9Т в области перепассивации. [30]
Страницы: 1 2 3 4 5
