Обмен - протон
Cтраница 2
В реакциях кислотно-основного взаимодействия происходит обмен протонов, в окислительно-восстановительных - обмен электронов между веществами, участвующими в реакции. [16]
Ионофор нигерицин вызывает почти электрически нейтральный обмен протонов на ионы калия. Поэтому его наличие в мембране вызывает выравнивание значений рН, но сохраняет значение разности электрических потенциалов. [17]
Во-вторых, р-метиласпартаза катализирует М2 - зависимый обмен протонов при р-углероде субстрата. [18]
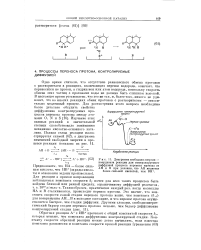 |
Диаграмма свободная энергия - координата реакции для контролируемого диффузией процесса переноса протона от АН к В при условии, что АН является более сильной кислотой, чем ВН. [19] |
Одно время считали, что отсутствие равновесного обмена протонов с растворителем в реакциях, включающих перенос водорода, означает, что переносится не протон, а гидрид-ион или атом водорода, поскольку скорость обмена этих частиц с протонами воды не должна быть слишком высокой. В настоящее время установлено, что это не так, и, более того, никого не удивляет, что во многих реакциях обмен протонов с растворителем - относительно медленный процесс. [20]
Был исследован ( Б.А.Геллер, Л.Ф.Кулиш) обмен протонов между грушами ОН и СООН п - и м-оксибензойных кислот в диметилсудьфо-ксиде. Обмен имеет первый порядок по веществу и по катализатору. Эти результаты объяснены соотношением констант писсошашш ОН и СООН групп и соответствующим механизмом. [21]
Это может происходить из-за того, что обмен протонов mpem - бутил-катиона с дейтерием из растворителя осуществляется быстрее, чем реакция переноса протона между изобутаном и трет-бутил-катионом. [22]
Гутовского: [86] в предположении, что обмен протонов аммонийной группы является мономолекулярным процессом. [23]
Сравнение различных классов соединений показывает, что обмен протона тиогидрильной группы тиолов со всеми изученными партнерами осуществляется намного медленнее, чем обмен протона гидроксильной группы соответствующих спиртов. Способность группы SH образовывать водородные связи в качестве донора и акцептора протона значительно ниже по сравнению с гидроксильной группой. Поскольку кислотность тиолов выше, чем у спиртов, можно заключить, что в данном случае скорость протонного обмена определяется в основном способностью молекулы образовывать водородные связи, а не ее кислотными свойствами. [24]
Наконец, последний член учитывает квантовомеханиче-ский эффект обмена сталкивающихся протонов. [25]
К настоящему моменту имеется мало данных о скоростях обмена сульфпидрильных протонов ( цистеин) с протонсодержащими растворителями. [26]
Для вывода уравнения, характеризующего АОСН рассмотрим вновь реакцию обмена протона в вакууме и сопоставим ее с константой аутопро-толиза - реакций диссоциации растворителя в вакууме. [27]
Описанные выше методы исследования обменных процессов не ограничены только обменом протонов. Тетрафторид серы имеет структуру с симметрией С2 с двумя наборами неэквивалентных атомов фтора. При комнатной температуре в спектре ЯМР фтора наблюдается один узкий пик. При понижении температуры пик сначала уширяется, а затем расщепляется на два широких пика. Было обнаружено, что скорость обмена в растворе зависит от концентрации SF4; это свидетельствует о бимолекулярном механизме. [28]
Для вывода уравнения, характеризующего / Сдосн, рассмотрим вновь реакцию обмена протона в вакууме и сопоставим ее с константой аутопро-толиза-реакций диссоциации растворителя в вакууме. [29]
В этом случае реакция контролируется кинетически и конденсация идет быстрее, чем обмен протона, приводящий к равновесию между возможными енолятами. [30]
Страницы: 1 2 3 4