Обмен - протон
Cтраница 3
Этот вывод полностью согласуется с известными экспериментальными данными, в частности с легкостью обмена протона при С-8 пуринов на дейтерий и тритий и с отсутствием обмена протона, связанного с атомом С-2 ( см. стр. Выше уже упоминалось, что галоидирование пуринов происходит с замещением водорода при С-8. Это превращение является примером электрофильных реакций. [31]
Для катионитов этого типа характерна высокая степень диссоциации и связанная с этим легкость обмена протонов на катионы из раствора электролита. Ионогенными группами в катионитах типа I чаще всего являются группы - SO3H, легко диссоциирующие на ион SO3 -, остающийся в матрице, и протон, являющийся противоионом. [32]
Диэлектрики ( твердые кислоты, основания и соли) катализируют реакции, сопровождающиеся обменом протонов - реакции гидратации, дегидратации, конденсации, полимеризации, изомеризации, крекинга. [33]
В противоположность этому карбоксильная группа - СООН в кислых растворах вовсе не способна вступать в реакцию обмена протона с другими катионами. [34]
Таким образом, выводы из теории Бренстеда о том, что диссоциация катионных кислот определяется только обменом протонов, и другие выводы из теории по отношению к катионным кислотам не оправдываются. Это, несомненно, является результатом того, что обсуждение влияния растворителей на силу катионных кислот основывалось Бренстедом и его последователями на универсальной схеме для кислот: ВН М МН В, что недопустимо. В этой схеме рассматривается не диссоциация оснований, а только процесс передачи протона от одной, уже образованной из основания катионной кислоты, к растворителю как к основанию, с образованием новой катионной кислоты. [35]
Таким образом, выводы из теории Бренстеда о том, что диссоциация катионных кислот определяется только обменом протонов и другие выводы из теории по отношению к катион-ным кислотам не оправдываются. [36]
Таким образом, выводы из теории Бренстеда о том, что диссоциация катионных кислот определяется только обменом протонов, и другие выводы из теории по отношению к катионным кислотам не оправдываются. Это, несомненно, является результатом того, что обсуждение влияния растворителей на силу катионных кислот основывалось Бренстедом и его последователями на универсальной схеме для кислот: RH - - M - MH 4 - R, что недопустимо. В этой схеме рассматривается не диссоциация оснований, а только процесс передачи протона от одной, уже образованной из основания катионной кислоты, к растворителю как к основанию, с образованием новой катионной кислоты. [37]
Выражение mNA / lOOO представляет фактическое число ионов в 1 см3; 7 5 105 - фактическую скорость обмена протонов в обоих направлениях, рассчитанную по уравнению ( 35); 55 - А / д - 10 - 3 - число молекул воды в 1 см3, 2 8 - 10 - 8 - общее расстояние переноса, приходящееся на один перескок. [38]
Так же, как и в случае других реакций, катализируемых бренстедовскими центрами, для получения измеряемой активности степень обмена протонов на эти катионы должна достигать 65 и 40 % соответственно. Скорость алкилирования зависит от содержания многозарядных катионов [171] и, следовательно, от концентрации протонов. [39]
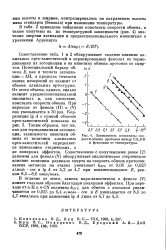 |
Зависимость константы скорости обмена протонов между СН3ОН и фенолами от температуры. [40] |
Сопоставление табл. 1 и 2 обнаруживает сходное влияние ал-кильных орто-заместителей в экранированных фенолах на термодинамику их ассоциации и на кинетику обмена протонов со спиртом. Потенциальный барьер об - [ п к мена Е, как и теплота ассоциации - АН, в пределах точности наших измерений не зависит от объема алкильных орто-групп. От этого объема, однако, сильно зависит предэкспоненциальный О множитель и, как следствие, константа скорости обмена. При переходе от фенола ( II) к ( V) она уменьшается в 30 раз. [41]
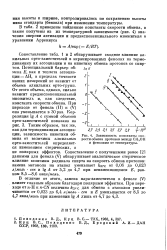 |
Зависимость константы скорости обмена протонов между СН3ОН и фенолами от температуры. [42] |
Сопоставление с полученными ранее [2] данными для фенола ( V) обнаруживает аналогическое стерическое влияние величины радикала спирта на скорость обмена протонов: замена метанола на этанол уменьшает feo c от 0 06 до 0 023 л / моль сек и lg А от 5 2 до 4 7 при неизменяющемся Е, равном 8 5 - 8 6 ккал / молъ. [43]
Протонирование бензола ( II) и его метилпроизводных в смеси HF - BF3 при - 70 С дает карбониевые ионы, обмен протонов в которых протекает настолько медленно, что они могут быть идентифицированы по ЯМР-спектрам. Кроме того, их существование в реакционных смесях может быть установлено различными способами. Например, для некоторых реакций замещения отсутствует кинетический изотопный эффект при замене водорода у реагирующего центра на дейтерий. Поскольку связь С - D прочнее, чем С - Н - связь, то, если бы гетеролиз связи С - Н являлся лимитирующей стадией в этих - реакциях, дейтери-рованные соединения реагировали бы медленнее, чем обычные. То, что в действительности этого не наблюдается, означает, что в лимитирующей стадии при взаимодействии электрофила и субстрата образуется интерме-диат, в котором связь С - Н все еще остается нетронутой. Таким интер-медиатом может быть лишь я - или а-комплекс, и если по каким-либо причинам я-комплекс приходится отбросить, то следует допустить наличие а-ком-плекса. SbFe, обнаруживают первичный кинетический изотопный эффект. Это свидетельствует о том, что разрыв связи С - Н, полностью или частично, является лимитирующей стадией реакции, но он не позволяет исключить образование о-комплекса в ходе реакции. [44]
Электронная теория применима к процессам, протекающим без участия растворителя, а также к тем сольвоси-стемам, в которых не происходит обмен протонов, к реакциям, протекающим при высоких температурах. [45]
Страницы: 1 2 3 4