Изотопный обмен - кислород
Cтраница 3
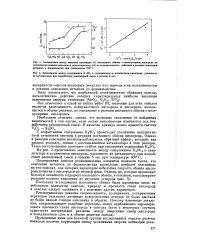
С возрастанием содержания K2S04 происходит увеличение каталитической активности системы в реакции изотопного обмена кислорода. Однако в реакции окисления метанола наблюдается обратный эффект, который, как удалось показать, связан с восстановлением катализатора в ходе реакции. На рис. 2 представлена зависимость между содержанием K2SO4 в катализаторе и количеством кислорода, удаленного из катализатора при воздействии реакционной смеси в течение 6 час при температуре 400 С. [32]
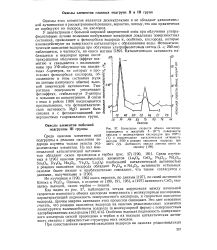
Как видно из рис. 37, наблюдается четкая корреляция между начальной скоростью изотопного обмена кислорода поверхности с молекулярным кислородом, характеризующей подвижность поверхностного кислорода, и скоростью окисления водорода, причем энергии активации этих процессов совпадают. Особенно высокая подвижность поверхностного кислорода окисей празеодима и тербия и их высокая каталитическая активность связаны с дефектностью структуры этих окислов. [34]
Работы Борескова с сотрудниками [82, 83] и Ройтера с сотруд-иками [84, 85] по изучению скоростей изотопного обмена кислорода а пятиокиси ванадия показали, что они значительно меньше, чем корости самого акта катализа. [35]
Сопоставление приведенных в табл. 3 величин заставляет сделать вывод о том, что скорость изотопного обмена кислорода изученных сульфатов зависит от природы щелочного элемента. Это свидетельствует о различной прочности связи кислорода в исследованных сульфатах. Максимальная энергия активации отмечается у сульфата калия. Соответствующие величины для сульфатов натрия и лития, с одной стороны, а также рубидия и цезия, с другой, закономерно снижаются. [36]
Подводя итоги рассмотрению реакций с участием кислорода, отметим, что закономерности подбора катализаторов для реакции окисления простых молекул, изотопного обмена кислорода и глубокого окисления углеводородов весьма близки. Это говорит о сходстве механизмов указанных реакций. [37]
 |
Корреляция между каталитической активностью кобальтитов в отношении реакций окисления водорода и метана и скоростью гомомоде-кулярного обмена кислорода. [38] |
Измерения упругости кислорода для шпинелей еще не закончены, и в качестве меры прочности связи поверхностного кислорода катализаторов принята скорость изотопного обмена кислорода. [39]
 |
Корреляция между каталитической активностью кобальтитов в отношении реакций окисления водорода и метана и скоростью гомомоде-кулярного обмена кислорода. [40] |
Измерения упругости кислорода для шпинелей еще не закончены, и в качестве меры прочности связи поверхностного кислорода катализаторов принята скорость изотопного обмена кислорода. [41]
Образование промежуточного продукта присоединения реагента по карбонильной группе может быть в некоторых случаях доказано химическими путем ( например, в случае гидролиза сложных эфиров, амидов и ангидридов кислот наличием изотопного обмена кислорода карбонильной группы [8, 10]) или физическими методами ( стр. [42]
 |
Кинетические характеристики глубокого окисления насыщенных кислот [ И5 ]. [43] |
Для характеристики прочности связи кислорода с поверхностью оксидного катализатора в разное время использовали различные величины: давление диссоциации оксидов при фазовых переходах, энтальпию образования оксидов из элементов, отнесенную к 1 моль кислорода, теплоту превращения низших оксидов в высшие, теплоту сорбции кислорода, восстанавливаемость оксидов, энергию активации изотопного обмена кислорода, скорость гомомолекулярного обмена кирло-рода и др. Из указанных величин первые три, связанные с фа-з овыми переходами оксидов, выбрали, исходя из представлений о том, что каталитическая реакция окисления в качестве промежуточных стадий включает переходы оксидов из одного фазового состояния в другое с различными валентными состояниями катионов. Сопоставление активностей оксидных катализаторов в реакциях глубокого окисления различных веществ со скоростями гомомолекулярного изотопного обмена кислорода на этих катализаторах выявляет достаточно четкие корреляции, однако некоторые оксиды ( например, оксид ванадия и оксид титана) выпадают из общей закономерности. [44]
 |
Кинетические характеристики глубокого окисления насыщенных кислот. [45] |
Страницы: 1 2 3 4