Обобществление - электрон
Cтраница 1
 |
К объяснению природы ковалентпой связи в молекуле водорода. [1] |
Обобществление электронов сопровождается перераспределением электронной плотности и изменением энергии системы по сравнению с суммарной энергией 2.0 изолированных атомов. [2]
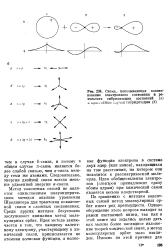 |
Схема. показывающая возникновение электронного состояния в результате гибридизации состояний ( а. [3] |
Идея обобществления электронов ( электрон принадлежит сразу обоим ядрам) при химической связи является весьма плодотворной. [4]
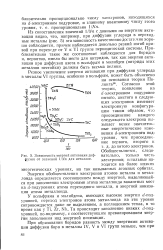 |
Зависимость энергий активации диффузии от значений l / Nn для металлов. [5] |
Энергия обобществления электронов атомов металла и металлоида определяется соотношением между энергией, выделяющейся при заполнении электронами атома металлоида вакантных мест на d - подуровнях атома переходного металла, и энергией ионизации атома металлоида. [6]
За счет обобществления электронов атомы становятся положительно заряженными ионами, которые обтекаются электронным газом, что и обусловливает связи между атомами ( ионами) в кристаллической решетке. Наличие электронного газа объясняет, в частности, высокую электропроводность металлов. [7]
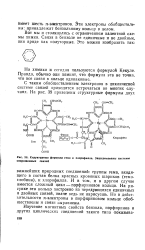 |
Структурные формулы тема и хлорофилла. Заштрихованы системы сопряженных связей. [8] |
С таким обобществлением электронов в циклической системе связей приходится встречаться во многих случаях. [9]
 |
Эффективные заряды е атомов соединений ArIBVI. [10] |
В ковалентных кристаллах обобществление электронов приводит к значительному повышению электронной плотности в направлениях связи и поэтому нельзя определить объем, ограничивающий один атом. Следовательно, и величина заряда оказывается зависящей от произвольно выбранных размеров атомного объема. Поэтому эффективный заряд следует рассматривать как некоторую экспериментально определяемую характеристику соединений, позволяющих их классифицировать. [11]
Она возникает в результате обобществления электронов между атомами. [12]
Идея его заключается в обобществлении электронов отдельных образующих молекулу атомов и распределении этих электронов но орбитам, характерным для молекулы в целом. [13]
 |
Схемы атомных и молекулярных орбиталей фтора. [14] |
Идея его заключается в обобществлении электронов отдельных образующих молекулу атомов и распределении этих электронов по орбиталям ( точнее - энергетическим уровням), характерным для молекулы в целом. [15]
Страницы: 1 2 3 4