Обобществление - электрон
Cтраница 2
Ковалентная связь возникает при обобществлении электронов двумя соседними атомами. [16]
Связи, возникающие в результате обобществления электронов, называются ковалентными связями, а два или несколько атомов, связанных воедино ковалентными связями, называют молекулой. [17]
Химические соединения происходят за счет обобществления электронов, находящихся на внешней орбите. [18]
Водородная связь возникает в результате сильного обобществления электрона атома водорода одним атомом и притяжения ядра атома водорода ( протона) другим электроотрицательным атомом. Металлическая связь осуществляется обобществленными электронами, образующими в металле электронный газ. Молекулярная связь осуществляется силами Ван-дер - Ваальса. [19]
При частично ковалентном характере связи ( обобществление электронов) имеет место большая или меньшая деформация электронных оболочек - явление, весьма близкое к поляризации ионов. Наконец, при ковалентной связи, когда кристалл можно считать состоящим из нейтральных атомов, его энергия полностью определяется энергией обобществленных нелокализованных электронов. [20]
Физически подобная коллективизация может мыслиться как обобществление электронов в системе ненасыщенных химических связей поверхностных атомов адсорбента: наличием некоторой плотности электронов, пропорциональной покрытию, в области между адсорбатом и поверхностью адсорбента. Подобно тому как электронная плотность между ионами водорода стабилизирует систему Нз, так и здесь она стабилизирует систему адсорбат - адсорбент. При этом, естественно, электроны, переходящие к адсорбенту от адсорбата или отданные адсорбату адсорбентом, должны быть с какой-то вероятностью приписаны всем поверхностным атомам адсорбента и всем адатомам: они делокализуются во всех ненасыщенных валентностях поверхности и всех допустимых состояниях адатомов. При эффективной толщине области делокали-зации ( 1 5 - 3) А [5] мы и приходим к модели двумерного Газа взаимодействующих электронов. [21]
Принимается, что при дисперсионных взаимодействиях обобществления электронов не происходит, и химическая связь не образуется. Одну из двух граничных моделей адсорбции, предполагающую, что при удержании молекул газа на поверхности адсорбента не происходит электронного обмена и образования химической связи, называют физической адсорбцией или зачастую просто адсорбцией. [22]
Энергию связи, возникающую в результате попарного обобществления электронов, называют часто обменной, так как ока возникает в результате якобы обмена атомов электронами. В действительности она является электростатической энергией взаимодействия электронного облака повышенной плотности, формирующегося между атомами, с ядрами этих атомов. [23]
Химическая связь, образованная за счет обобществления электронов связываемых атомов, называется ковалентной. [24]
Перекрытие электронных облаков, приводящее к обобществлению электронов, не сводится к простому наложению друг на друга двух сферически симметричных электронных облаков изолированных атомов, а сопровождается существенным перераспределением электронной плотности и изменением энергии системы. При обобществлении электронов происходит втягивание электронных облаков в пространство между ядрами атомов: в пространстве между ядрами плотность электронного облака будет больше, чем должна была бы получиться плотность облака при простом сложении двух электронных облаков изолированных-атомов, в то же время на небольшом расстоянии от ядер вне этого пространства плотность электронного облака становится меньше, чем в изолированных атомах. Штриховая линия / показывает плотность электронных облаков изолированных атомов, пунктирная линия 2 показывает суммарную плотность, которая получилась бы при простом наложении электронных облаков двух изолированных атомов, сближенных до расстояния г, на участках /, 2 кривые 1 и 2 практически сливаются. Сплошная жирная кривая 3 показывает распределение плотности электронного облака в молекуле водорода вдоль оси, соединяющей ядра атомов. [25]
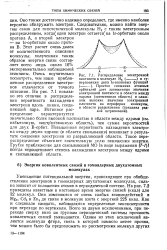 |
Распределение электронной плотности в молекуле Н2 ( - - - - - - - - и су. [26] |
Уменьшение потенциальной энергии, происходящее при обобществлении электронов в гомоядерных двухатомных молекулах, сильно зависит от положения атомов в периодической системе. На рис. 7.2 приведены известные в настоящее время энергии связей ( ккал) для 32 молекул. Они изменяются от очень слабых взаимодействий в Hg2, Cd2 и Zn2 до связи в молекуле азота с энергией 225 ккал. Как и следовало ожидать, наблюдаются определенные закономерности при переходе по вертикали. Всего за двумя исключениями, при переходе сверху вниз по группам периодической системы прочность ковалентных связей уменьшается. [27]
Следовательно, при образовании металлической связи происходит обобществление электронов не между двумя атомами, а в объеме всего кристалла. Таким образом, кристалл металла состоит из положительно заряженных ионов, которые удерживаются вместе общим электронным облаком. [28]
Чис ло атомов, с которыми происходит обобществление электронов, зависит от валентности элемента и может быть определено согласно правилу 8 - W, где N - номер группы периодической системы. [29]
При больших расстояниях между молекулами, когда обобществление электронов еще не происходит, движение электронов в молекулах все-таки до известной степени взаимосвязано. Электроны молекулы с как бы отталкиваются от электронов молекулы d или избегают их. Эта корреляция движений электронов является еще одной причиной возникновения межмолекулярных взаимодействий. Лондон назвал дисперсионными силами. В настоящее время распространен термин лондоновские силы. [30]
Страницы: 1 2 3 4