Валентная оболочка
Cтраница 1
Валентные оболочки, содержащие более шести электронных пар, редко встречаются ( гл. Наличие более девяти электронных пар на валентной оболочке является очень необычным, поэтому, хотя икосаэдрическая конфигурация 12 электронных пар известна, она реализуется чрезвычайно редко. В настоящей книге обсужден ряд других многогранников, не являющихся правильными, но в подавляющем большинстве случаев с треугольными гранями. [1]
Объемистые валентные оболочки этих элементов способны вместить по крайней мере 9 электронных пар, и с этой стороны не возникает каких-либо ограничений координационного числа, которое могут иметь указанные элементы. Однако его будет ограничивать заряд, который элементы способны принять. Поэтому координационное число 6 осуществляется только с таким электроотрицательным лигандом, как фтор. В табл. 7.2 указаны типы обнаруженных экспериментально геометрических конфигураций молекул этих элементов. [2]
Валентная оболочка атома хлора в основном состоянии имеет конфигурацию 3s2 / 5 - на четырех АО находится семь электронов. Атомы хлора присоединяют электроны и переходят в ионы СГ с выделением 345 кДж / моль. Из всех элементов хлор имеет самое большое сродство атома к электрону. [3]
Валентная оболочка атома бора характеризуется наличием одного 2з - электрона и двух 2 / - электронов. [4]
 |
Пространственная конфигурация гибридных связей в молекуле. [5] |
Валентная оболочка возбужденньис атомов элементов IV периода содержит один s - и три р-электрона, которые образуют sp3 - rpynny. [6]
Строение валентной оболочки атомов позволяет определить их валентность по числу неспаренных электронов. Правильные валентности, как видно из рис. 1.5, получаются для 3Li и для 7N - Ю Ne, но не для элементов 4Ве - 6С, валентности которых оказываются пониженными на две единицы. Это противоречие устраняется, если учесть, что атомы могут образовывать химические связи не только в основном, но и в возбужденном состоянии, если энергия возбуждения не превышает энергии образующихся химических связей. [7]
АО валентных оболочек атомов, составляющих молекулу) взаимно ортогональны, поскольку орбитали одного атома образуют ортогональный набор и мы пренебрегаем перекрыванием между АО разных атомов. [8]
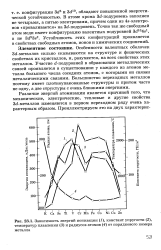 |
Зависимость энергий ионизации ( 1, констант упругости ( 2, температур плавления ( 3 и радиусов атомов ( 4 от порядкового номера металла. [9] |
Особенности валентных оболочек Sd-металлов сильно сказываются на структуре и физических свойствах их кристаллов, и, разумеется, на всех свойствах этих металлов. Участие d - подуровней в образовании металлических связей проявляется в существовании у каждого из атомов металла большого числа соседних атомов, с которыми он связан металлическими связями. Большинство переходных металлов поэтому имеет плотноупакованные структуры и притом часто не одну, а две структуры с очень близкими энергиями. [10]
Строение валентной оболочки элементов принято изображать с помощью символической записи электронов в виде точек. При таком схематическом изображении остов атома условно указывается символом данного химического элемента, а его валентные электроны-соответствующим числом точек, окружающих этот символ. Схематические изображения всех элементов группы AI отличаются только своими остовами: Li, Na, К, Rb и Cs, так как атомы этих элементов обладают валентными оболочками с одинаковым строением. [11]
Расширение валентной оболочки атома серы, очевидно, не единственный фактор, способствующий стабилизации карбаниона. Бреслоу [87] сомневается в том, что степень такой стабилизации определяется геометрическими ограничениями для перекрывания орбиталей. Однако структура XLI изоэлектронна с дегидробензольной системой, и, вероятно, перекрывание орбиталей в системе XLI осуществляется даже лучше, поскольку могут использоваться d - орбитали. Так как почти ничего не известно о специфических геометрических условиях для эффективного перекрывания в случае d - орбиталей, то решить этот вопрос трудно. [12]
 |
Благородные газы. [13] |
Устойчивость целиком заполненных валентных оболочек атомов определяет химическую инертность благородных газов. [14]
Электроны валентной оболочки атомов элементов главных подгрупп I и II групп находятся на значительно большем расстоянии от атомного ядра, чем электроны внутренних уровней. Это можно видеть из большой разности, которая существует между атомными ( стр. [15]
Страницы: 1 2 3 4 5