Валентная оболочка
Cтраница 4
 |
Схема относительных уровней энергии d - орбиталей высоко - и низкоспиновых электронных конфигураций катионов Fe ( II и Fe ( III для квадратно-плоскостной симметрии. 4 / j. [46] |
Распределение электронной плотности валентной оболочки катиона переходного металла непосредственно связано с угловой зависимостью соответствующих волновых функций, которые описывают конфигурацию d - орбиталей. В катионах переходных металлов, таких, как Fe ( II) и Fe ( III), имеется пять d - орбиталей: Ах - у - -, dzt, dxy, dxz и dyz. В отсутствие координированных лигандов орбиты пятикратно вырождены. [47]
Фтор тоже имеет переполненную валентную оболочку, и его три неподеленные пары стремятся к делокализации на атом углерода. [48]
Если же на валентной оболочке находятся только четыре электронные пары, то, хотя они и расположены в результате взаимного отталкивания тетраэдрически, они не занимают всего доступного пространства, поэтому валентные углы между электронными парами могут легко изменяться. В молекуле SiH4 валентный угол является тетра-эдрическим в результате симметричного строения молекулы. Молекула H2S имеет две неподеленные пары электронов, и, казалось бы, должно произойти дальнейшее уменьшение угла. [49]
Чтобы иметь в валентной оболочке 18 элеггронов, структура рутеноцена должна быть искажена таким образом, чтобы одно из бензольных колец участвовало в связывании лишь двумя я-связями. Именно такая структура XXXVIII найдена для перметильного производного рутеноцена. В отличие от неполярного симметричного хромоцена IX молекула XXXVIII характеризуется достаточно высоким довольным моментом 2 03 D в растворе. Другой аналогичный пример - искажение пятичлен-ного циЕлопентадиенового кольца в сэндвичевом вольфрамдикар-бонильном комплексе XXXIX, позволяющее вывести одну л-связь ( два электрона) из общего связывания. [50]
 |
Орбитали связывающих и неподеленных электронных пар в молекулах СН4, NHj и Н2О. [51] |
При размещении на валентной оболочке неподеленных пар они стремятся занять такие положения, где их взаимодействие друг с другом минимально. [52]
А расположенные под валентными оболочками d - орбиты заполнены лишь частично, тогда как атомы металлов группы В имеют заполненные d - оболочки. [53]
Рассмотрим атом с валентной оболочкой sp3, например атом углерода. [54]
Таким образом, его валентная оболочка имеет одну занятую орбиталь и его электроны спарены. [55]
Одинаковые по электронной конфигурации валентные оболочки элементов-аналогов различаются энергией валентных электронов и размерами электронных облаков, зависящих от эффективного заряда, действующего на каждый валентный электрон. [56]
В обычном двухвалентном состоянии валентная оболочка бериллия в соединениях ВеХ2 не заполнена полностью, поэтому он охотно выступает в роли акцептора электронов с образованием комплексов. Из данных табл. 2.1 видно, что бериллий имеет на валентной оболочке место, достаточное для размещения 6 электронных пар. Однако приобретение 4 дополнительных электронных пар с образованием комплекса связано с появлением на атоме бериллия слишком большого заряда, поэтому такие соединения практически не встречаются. [57]
Элементы, начинающие застройку валентной оболочки, образуют металлические связи, являющиеся ненаправленными и ненасыщенными. [58]
При учете всех электронов валентной оболочки каждый атом может вносить более одной орбитали. При этом упрощающие предположения, описанные выше, становятся необос нованными. Соответствующие члены перекрывания 8) в знаменателе выражения (10.44) обращаются в нуль, но члены ri в числителе остаются отличными от нуля. Рассмотрим, например, случай, когда ф является s - AO атома т, а ф ] - р - АО того же атома. [59]
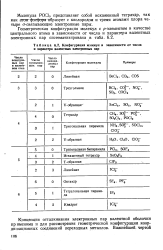 |
Конфигурация молекул в зависимости от числа и характера валентных электронных пар. [60] |
Страницы: 1 2 3 4 5