Валентная оболочка
Cтраница 3
Если на валентной оболочке атома возможны альтернативные положения одной или нескольких неподеленных пар, они стремятся занимать такие положения, где их взаимодействия с другими электронными парами минимальны. [31]
Когда в валентной оболочке центрального атома присутствуют пять электронных пар, обычно реализуется конфигурация тригональной би-пирамиды, хотя в некоторых случаях возможна и тетрагональная пирамида, а также и промежуточные конфигурации, найденные в ряде специальных структур. На самом деле для тригонально-бипирамидальных структур характерны перегруппировки, сопровождающиеся низкочастотным движением большой амплитуды. [32]
 |
Структуры ионных кристаллов состава А В. а тип CsCl. б тип NaCl. в тип a - ZnS ( сфалерит. [33] |
Ионы с заполненными валентными оболочками обладают сферической симметрией. [34]
Металл с простой валентной оболочкой ( s - зона) является типичным донором электронов. Плотность уровней в такой зоне невелика. Это значит, что увеличение числа электронов в ней приводит к значительному увеличению полной энергии системы, которое лишь в редких случаях может быть скомпенсировано за счет образования химической связи. [35]
В данном случае валентная оболочка содержит 5 электронных пар, причем 2 неподеленные пары занимают экваториальные положения в общей конфигурации тригональной бипирамиды. Величины длин связей и валентных углов согласуются с представлением о сильном отталкивании неподеленных пар ( гл. [36]
Как известно, валентная оболочка атомов в кристалле находится обычно в некотором гибридизирова-нном состоянии, симметрия которого соответствует симметрии упаковки атомов в кристалле. Часто симметрия гибридизированной валентной оболочки определяет симметрию упаковки атомов и, следовательно, симметрию распределения масс и сил взаимодействия атомов, как, например, в алмазе, кремнии или германии. [37]
В этой формуле валентная оболочка иода состоит из десяти электронов. [38]
Богатая электронно-орбитальными вакансиями валентная оболочка атома железа позволяет ему, в дополнение к четырем связям с атомами азота плоско-квадратной конфигурации, образовать еще две в направлении оси, перпендикулярной к плоскости порфири-новой системы, образуя таким образом бипирамидальный комплекс. Этими дополнительными лигандами обычно бывают фрагменты полипептидных цепочек ( чаще - имидазольный цикл гистидина, иногда - сульфидная сера метионина) с одной стороны и малые молекулы нуклеофильного характера ( Н20, 02, CM -, CO, N3 - и др.) с другой стороны плоско-квадратного фрагмента. В отличие от порфирина, корриновый цикл имеет на одно метиновое звено меньше, что довольно существенно отражается на его Ti-электронной структуре: в молекуле отсутствует циклическая дело-кализация - следовательно, она уже не ароматична. [39]
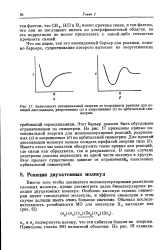 |
Зависимость потенциальной энергии от координаты реакции для реакций диссоциации, разрешенных ( а и запрещенных ( б по орбитальной симметрии. [40] |
Приведены только МО валентной оболочки. [41]
Так, из валентной оболочки одного атома в валентную оболочку другого атома, ликвидируя дефектную связь, хаотически движется электрон. Вместо этого удобнее считать, что в валентной зоне в обратном направлении движется дырка, которая имеет положительный заряд, равный по величине заряду электрона. [42]
Если все электроны валентной оболочки используются для образования о-связей, возни-чает октаэдрическая структура, как в SF6, SeFe или TeF6 и в замещенных молекулах типа SF5C1 и SFsBr. Молекулы S2Fi0 и S2O2Fi0 также имеют октаэдрические структуры, в которых группы SFg соединяются мостиками S-S и S-О - О-S соответственно. [43]
 |
Узел химических связей при я / Лгибридизации атома.| Узел химических связей при sp - гибридизации атома. [44] |
Если бы электроны валентной оболочки вели себя при образовании химических связей независимо, то атом С образовал бы три связи под углом 90 друг к другу ( за счет рх -, ру -, электронов) и одну химическую связь в произвольном направлении. Тогда четыре химических связи в СН4 или в ( СН3) 4С были бы неэквивалентны. Одна связь за счет s - электрона была бы менее прочна, чем три других, так как р-электроны дают большую степень перекрывания электронных облаков соседних атомов, чем s - электрон. [45]
Страницы: 1 2 3 4 5