Валентная оболочка
Cтраница 2
В заполненной валентной оболочке электроны занимают все доступное пространство вокруг центрального остова. В рамках простой модели жестких сфер это означает, что вокруг центрального остова образуется плотная упаковка сфер, моделирующих электронные облака, и координация дополнительных сфер невозможна. Для незаполненных валентных оболочек в рамках той же модели возникает следующая картина: после расположения всех сфер на валентной оболочке еще остается свободное пространство, достаточное для одной или более дополнительных электронных пар. Поскольку сферы не касаются друг друга, не существует силы, противодействующей уменьшению валентных углов между электронными парами, до тех пор, пока сферические орбитали не коснутся друг друга. В этом случае электронная плотность, особенно в пространстве между электронными парами, будет ничтожно малой, так что взаимодействие электронных пар окажется очень слабым. Поэтому такие электронные пары могут сравнительно легко сближаться до достижения некоторого критического положения, после чего начинается резкое увеличение отталкивания между электронными облаками, которое препятствует их дальнейшему сближению. В большинстве соединений углерода, азота, кислорода и фтора их валентная оболочка полностью заполнена четырьмя электронными парами. Эти четыре электронные пары расположены тетраэдрически и занимают все доступное пространство вокруг центрального остова, поэтому искажение такой структуры затруднено. [16]
 |
Угловая зависимость тет-раэдрической орбиты с направлением связи вдоль оси х. [17] |
В валентной оболочке атома углерода имеются четыре орбиты. Если бы квантовая теория разрабатывалась не спектроскопистами, а химиками, то, возможно, что вместо s - и р-орбит фундамен - тальную роль играли бы описанные ниже тетраэдрические орбиты. Вообще волновая функция для системы может быть построена путем сложения разных функций. Энергия системы, состоящей из атома углерода и четырех присоединенных атомов, будет минимальной в том случае, когда энергия связи имеет наибольшое значение. Оказалось, что связывающая орбита, образованная линейной комбинацией s - и р-орбит, взятых с определенными числовыми коэфициентами, имеет большую прочность связи чем s - или р-орбита в отдельности. Легко понять, что эта орбита будет сильно перекрываться с орбитой другого атома и будет образовывать очень прочную связь. [18]
В валентной оболочке иона бромоиия Вг имеется всего шесть электронов. С помощью пары я-электронов бензола он образует простую связь с атомом углерода. Но в результате в валентной оболочке соседнего атома углерода остается только шесть электронов. Такая частица довольно неустойчива. Отщепление протона от связанного с бромом атома углерода превращает эту частицу в более устойчивую молекулу бромбензола. Таким образом происходит замещение атома водорода ароматического цикла атомом брома. [19]
В полностью заполненной валентной оболочке меньше доступного пространства, чем в частично заполненной. По этой причине в заполненной оболочке отталкивания проявляются сильнее, а возможности для угловых изменений меньше, чем в частично заполненной оболочке. [20]
 |
Структура аниона Т1 аС. [21] |
На валентных оболочках этих элементов имеется 4 электрона. На образование связей могут использоваться все 4 электрона и состояние окисления будет 4 или же только два из них, тогда состояние окисления будет 2 и остается одна неподеленная пара. Объемистые валентные оболочки рассматриваемых элементов, даже в случае кремния, могут притягивать до 8 электронных пар, так что с этой стороны на возможное координационное число не накладывается никаких ограничений. Однако оно, как и для предыдущей группы, определяется зарядом, который эти элементы способны принять. В табл. 7.3 приведены найденные экспериментально геометрические формы молекул. [22]
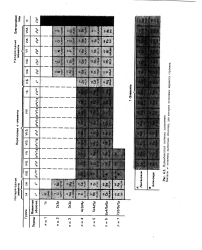 |
Периодическая система элементов. [23] |
Значком отмечены валентные оболочки, для которых возможны варианты строения. [24]
 |
Хемосорбция ак - Хемосорбция акцепторной цепторнои молекулы, v. [25] |
Так, валентные оболочки серебра, меди и золота не являются оболочками s - типа в чистом виде, как можно было бы ожидать на основании электронной структуры атомов этих металлов. [26]
Для образования валентной оболочки с конфигурацией d10 нужны четыре пары связывающих электронов, причем эта оболочка имеет такую же электронную конфигурацию, как и соседний инертный газ. Такие соединения являются тетраэдрическими. Но хотя 4-координационная система является открытой, в ней нет легко доступных орбиталей, чтобы реакция могла идти по ассоциативному механизму. [27]
 |
Корреляционная диаграмма для двухатомных молекул с различными ядрами. Вертикальная штриховая линия характеризует состояние в молекуле NO. [28] |
Разрыхляющие орбитали валентной оболочки. [29]
Электронная конфигурация валентной оболочки атомов этих элементов s2p4 в значительной степени определяет их химическое поведение. В соответствии с правилом Хунда на двух из трех р-орбиталей находится по одному неспаренному электрону. Тем самым у атома возникает возможность образовать две ко-валентные связи путем соединения с двумя атомами того же ли иного вида. [30]
Страницы: 1 2 3 4 5