Образование - молекулярный орбиталь
Cтраница 1
Образование молекулярных орбиталей из атомных подчиняется в общем случае следующему правилу: перекрывание атомных орбиталей ( интерференция электронных волн) тем более вероятно, чем ближе они по энергетическим уровням и чем более сходны по симметрии. [1]
Образование молекулярных орбиталей из атомных приводят в виде так называемых корреляционных диаграмм, представляющих собой схематическое изображение изменений энергии молекулярных орбиталей при изменении межъядерного расстояния. Они характеризуют вид образующихся МО, необходимый для этого набор АО, количество электронов и последовательность заполнения ими молекулярных орбиталей в отдельных молекулах. [2]
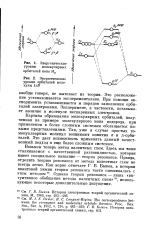 |
Энергетические уровни молекулярных орбиталей иона Н2.| Энергетические уровни орбиталей молекулы LiH. [3] |
Картина образования молекулярных орбиталей, полученная на примере молекулярного иона водорода, при применении к более сложным системам обогащается новыми представлениями. Так, уже в случае простых го-монуклеарных молекул возникают понятия а и я-орби-талей. Это дает возможность применять данный качественный подход к еще более сложным системам. [4]
Условием образования молекулярных орбиталей из атомных является: 1) близость энергий взаимодействующих АО; б) возможность их перекрывания; 3) одинаковая симметрия относительно оси симметрии - линии связи в молекуле. [5]
 |
Диаграмма энергетических металла, степени его окисления, уровней, иллюстрирующая расще - размера иона, расстояния d - орби-пление d - орбиталей. талей от ядра атома. Величина. [6] |
При образовании молекулярных орбиталей комбинируются лишь атомные орбитали, обладающие одинаковыми свойствами симметрии. [7]
Метод МО предусматривает образование молекулярных орбиталей, осуществляющих связь между атомами, из тех атомных орбиталей, которые взаимно перекрываются в достаточной степени. В зависимости от симметрии связи молекулярных орбиталей относительно линии, связывающей ядра атомов ( см. гл. [8]
Рассмотрим теперь возможность образования молекулярных орбиталей двухатомной молекулы из Is - и 25-орбиталей каждого ее атома. [9]
 |
Схема образования молекулярных орбиталей в молекуле Н2. [10] |
На рис. 34 показано образование молекулярных орбиталей ( МО) из атомных орбиталей ( АО) 3s в поле ядер молекулы Нг - cr - Орбиталь характеризуется меньшим запасом энергии, чем АО изолированного атома, и называется связывающей. Орбиталь является состоянием энергетически менее выгодным, чем состояние Is ( АО) атома водорода. Вопрос об образовании молекулы сводится, таким образом, к вопросу о том, что энергетически более выгодно для электронов: оставаться в изолированных атомах или перейти на молекулярные орбитали. Молекула Не2 согласно методу МО невозможна, потому что предусматривает заполнение орбитали а двумя электронами. Поэтому связующее действие двух электронов компенсируется разрыхляющим действием двух других. [11]
Что показывают энергетические диаграммы образования молекулярных орбиталей. [12]
Предполагают, что благодаря образованию замкнутых молекулярных орбиталей в молекуле бензола под влиянием внешних факторов может возникать некоторый кольцевой ток вследствие движения электронов по кольцу. [13]
Изучение характера гибридизации при образовании молекулярных орбиталей позволяет подойти к обсуждению структуры молекул на основании метода МО. Все сказанное выше как будто бы приводит к выводу о полном успехе теории молекулярных орбиталей. Основное замечание заключается в том, что метод МО недооценивает тенденцию электронов к отталкиванию. [14]
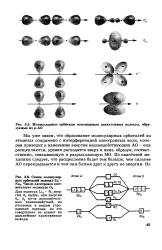 |
Молекулярные орбитали гомоядерных двухатомных молекул, образуемые из р - АО.| Схема молекулярных орбиталей молекул 14 - Ne2. Число электронов соответствует молекуле О2. [15] |
Страницы: 1 2 3 4 5