Образование - молекулярный орбиталь
Cтраница 2
Мы уже знаем, что образование молекулярных орбиталей из атомных сопряжено с интерференцией электронных волн, которая приводит к изменению энергии взаимодействующих АО - они расщепляются, уровни расходятся вверх и вниз, образуя, соответственно, связывающую и разрыхляющую МО. Из квантовой механики следует, что расщепление будет тем больше, чем сильнее АО перекрываются и чем они ближе друг к другу по энергии. [16]
Ради простоты на нем показано образование молекулярных орбиталей только из 2р - атомных орбиталей. [17]
На рис. 46 показана диаграмма образования молекулярных орбиталей и их заполнение электронами для молекулы СО. Энергии атомных орбиталей кислорода лежат ниже соответствующих орбиталей углерода, они расположены ближе к ядру, так как кислород имеет больший, чем углерод потенциал ионизации. Имеющиеся в исходных атомах на внешних слоях 10 электронов заполняют связывающую и разрыхляющую aCB2s - и а Зз-орбитали и связывающие ясв 2р - и стсв 2рж - орбитали. [18]
На рис. 1.8 приведена схема образования молекулярных орбиталей по методу ЛКАО. [19]
 |
Возможные комбинации орбиталей лигандов с образованием групповых орбиталей. [20] |
Орбиталь dxy не участвует в образовании молекулярных орбиталей, поскольку она не перекрывается с орбиталями лигандов, а групповая орбиталь лигандов aig и орбитали металла и. [21]
Механизм образования молекулы можно представить как образование молекулярных орбиталей вследствие энергетически наивыгоднейшего перекрывания атомных орбиталей. Однако свойства молекулы не являются просто суммой свойств образующих ее атомов. В электронной системе молекулы вероятность пребывания любого электрона в поле каждого атома ( ядра) отлична от нуля. Так, в молекуле водорода нельзя различить, к какому атомному ядру относятся отдельные электроны. Поэтому принцип Паули справедлив и для молекулы в целом. [22]
Какие орбитали дают наибольший вклад в образование молекулярных орбиталей. [23]
Механизм образования молекулы можно представить как образование молекулярных орбиталей вследствие энергетически наивыгоднейшего перекрывания атомных орбиталей. Однако свойства молекулы не являются просто суммой свойств образующих ее атомов. В электронной системе молекулы вероятность пребывания любого электрона в поле каждого атома ( ядра) отлична от нуля. Так, в молекуле водорода нельзя различить, к какому атомному ядру относятся отдельные электроны. Поэтому принцип Паули справедлив и для молекулы в целом. [24]
В соответствии с изложенными выше принципами образования молекулярных орбиталей и теории валентных связей может быть представлена структура отдельных молекул и выяснена качественная картина образования связей. [25]
 |
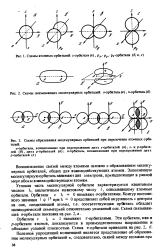
Схема образования связывающей и разрыхляющей молекулярных о-орбиталей. [26] |
Чтобы атомные орбитали могли комбинироваться с образованием молекулярных орбиталей, необходимы следующие условия: атомные орбитали должны иметь близкие энергии, перекрываться в заметной степени, иметь одинаковую симметрию относительно линии связи в молекуле. [27]
Возникновение связей между атомами связано с образованием молекулярных орбиталей, общих для взаимодействующих атомов. Заполненную молекулярную орбиталь занимают два электрона, принадлежащие в равной мере обоим взаимодействующим атомам. [29]
 |
Схема образования связывающей и разрыхляющей молекулярных о-орбиталей. [30] |
Страницы: 1 2 3 4 5