Образование - молекулярный орбиталь
Cтраница 3
Чтобы атомные орбитали могли комбинироваться с образованием молекулярных орбиталей, необходимы следующие условия: атомные орбитали должны иметь близкие энергии, перекрываться в заметной степени, иметь одинаковую симметрию относительно линии связи в молекуле. [31]
 |
Некоторые из молекулярных орбиталей молекулярного соединения иода с основанием. [32] |
Орбитали пь и о комбинируются с образованием молекулярных орбиталей комплекса ос и о, из которых связывающая тс-орби-таль является в основном ь-орбиталью, а о - в основном о - орбиталью. Поскольку о несколько выше по энергии, чем соответствующая ей орбиталь о, переход в молекулярном со единении ( стрелка 2 на рис. 6 - 8) требует несколько большей энергии, чем эквивалентный переход в свободной молекуле Ь ( стрелка /), и наблюдается гипсохромное смещение. Этого и следует ожидать на основании качественного рассмотрения рис. 6 - 8, если только энергия л лишь незначительно отличается от энергии л или если изменение энергии связано линейной зависимостью с изменением энтальпии ДЯ. [33]
 |
Энергетические диаграммы двухатомных молекул и ионов элементов второго периода Периодической системы. [34] |
Вследствие этого появляются существенные отличия в образовании молекулярных орбиталей у некоторых гетероядерных молекул от гомоядерных. [35]
Для наглядного представления об энергетических соотношениях при образовании молекулярных орбиталей из атомных строят диаграммы уровней энергии. По вертикали вверх идет увеличение энергии орбиталей, а книзу - ее падение. [36]
Причиной образования связи является выигрыш энергии при образовании молекулярных орбиталей и помещении на них электронных пар. Эти пары стано вятся общими для двух атомов, между которыми возникает химическая связь. Конечно, связь может образоваться, если на связывающей орбитали будет всего один электрон. [37]
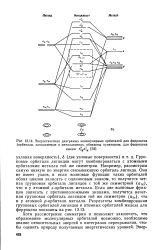 |
Энергетическая диаграмма молекулярных орбиталей для ферроцена ( орбитали, заполняемые в металлоценах, обведены пунктиром. для ферроцена. [38] |
Хотя рассмотрение симметрии и позволяет заключить, что образование молекулярных орбиталей возможно, необходимо знание относительных энергий и интегралов перекрывания, чтобы оценить природу получаемых энергетических уровней. [39]
 |
Схема уровней атомных и молекулярных орбиталей водорода. [40] |
Для того чтобы атомные орбитали могли взаимодействовать с образованием молекулярных орбиталей, они должны, во-первых, иметь близкие энергии, во-вторых, перекрываться в заметной степени и, в-третьих, иметь одинаковую симметрию относительно линии связи в молекуле. [41]
Такая система координат позволяет рассмотреть особенности перекрывания атомных и образования молекулярных орбиталей. Атом углерода имеет во внешнем электронном слое 2s - и 2 / 7-орбитали, на которых расположены четыре электрона. Атомные ls - орбитали четырех атомов водорода будут перекрываться с 2s - и 2р - АО углерода. [42]
Взаимодействие гибрндазовакных электронов о АО приближающихся атомов приводит к образования молекулярных орбиталей ( МО) и образовании молекул, если образование МО аз АО сопровождается выигрышем в энергии. [43]
Для того, чтобы атомные орбитали могли взаимодействовать с образованием молекулярных орбиталей, они должны, во-первых, иметь близкие энергии, во-вторых, перекрываться в заметной стгпени и, в-третьих иметь одинаковую симметрию относительно линии связи в молекуле. [44]
 |
Образование разрыхляющей молекулярной орбитали.| Молекулярные орбитали в молекуле водорода. [45] |
Страницы: 1 2 3 4 5