Образование - молекулярный орбиталь
Cтраница 4
На рис. 7.10 показаны изменения энергии, происходящие при образовании молекулярных орбиталей молекулы водорода. При взаимодействии ls - орбиталей двух атомов водорода, На и Нь, образуются связывающая и разрыхляющая молекулярные орбитали. Связывающая орбиталь обладает энергией на 4 5 эВ ниже, чем исходные 15тОрбитали изолированных атомов На и Нь, а разрыхляющая орбиталь, наоборот, выше их по энергии приблизительно на такую же величину. [46]
Очевиден механизм образования веществ с атомной или ионной связью: образование молекулярных орбиталей, приводящее к понижению энергии системы в результате перехода электронов на более низко лежащие энергетические уровни, а также перераспределение электронной плотности, обусловливающее электростатическое притяжение между ионами. [47]
Она основывается на взаимодействии орбиталей атомов, которое приводит к образованию сложных многоцентровых молекулярных орбиталей. Молекулярные орбита-ли располагаются на различных энергетических уровнях. [48]
 |
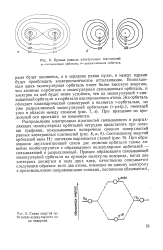
Смешивание двух атом - символы - ф и i, но чтобы ука-яых s - орбиталей при образовании зать, Какие - атомные орбитали молекулярных орбиталей. участвовали в образовании молеку. [49] |
Некоторые новые проблемы появляются при обсуждении смешивания атомных р-орбиталей в ходе образования молекулярных орбиталей. Здесь следует вспомнить свойства р-орбиталей: во-первых, для каждого главного квантового числа ( л 2) существуют три эквивалентные р-орбитали, - рх, ру, pz, и они расположе - - ны под прямыми углами друг к другу; во-вторых, две лопасти р-орбитали имеют противоположные знаки. [50]
Полные корреляционные диаграммы достаточно сложны, поэтому на практике для характеристики образования молекулярных орбиталей из атомных пользуются упрощенными схемами. [51]
 |
Кривые равных электронных плотностей. а-связывающая орбиталь. б-разрыхляющая орбиталь. [52] |
При образовании двухэлектронной связи две атомные орбитали также линейно комбинируются с образованием молекулярных орбиталей - связывающей и разрыхляющей. [53]
 |
Валентные состояния углерода. [54] |
При образовании двухэлектронной связи две атомные орбитали также линейно комбинируются с образованием молекулярных орбиталей - связывающей и разрыхляющей. Процесс образования связывающей молекулярной орбитали на примере молекулы водорода, когда два электрона движутся в поле двух ядер, качественно описывается следующим образом: если два атома, имеющие по одному электрону с противоположно направленными спинами, постепенно сближаются, то между ними начинают действовать силы притяжения; на близком же расстоянии возникают силы отталкивания, которые быстро возрастают. [55]
Поэтому атомные орбитали с очень низкой энергией с трудом участвуют в образовании молекулярных орбиталей, и по этой причине электронами внутренних орбита-лей можно пренебречь при рассмотрении связей - такие электроны являются несвязывающими. [56]
Какие из комбинаций орбиталей атомов водорода и фтора энергетически наиболее приемлемы для образования молекулярных орбиталей. [57]
При описании комплекса по методу МО орбитали лиганда и иона металла смешиваются с образованием молекулярных орбиталей. Эта плотность неспаренных электронов-взаимодействует с ядром, спектр ЯМР которого исследуется, по такому же принципу, что и механизм прямой делокализации, рассмотренный в посвященной методу ЭПР гл. Интерпретация данных по контактному сдвигу в терминах связывания затруднена по двум причинам. Методами ЭПР и ЯМР регистрируют плотность неспаренного спина. В дополнение к прямой делокализации плотности неспаренных электронов спин делокализуют косвенные механизмы поляризации спинов. [58]
Лепестки большего объема располагаются по разные стороны узловой плоскости; именно они участвуют в образовании молекулярных орбиталей. [59]
При сближении атомов энергетические уровни электронов расщепляются по тем же основаниям, по каким вообще происходит образование молекулярных орбиталей из атомных. Если сближаются два одинаковых атома, имеющих каждый по одному электрону, то вместо одного уровня в получившемся соединении их будет два, при соединении трех и более атомов расщепление приведет к возникновению трех или большего числа уровней. [60]
Страницы: 1 2 3 4 5