Образование - ионные пары
Cтраница 1
Образование ионных пар и более крупных групп ионов приобретает очень большое значение по мере возрастания зарядов ионов и уменьшения диэлектрической проницаемости среды. [1]
Образование ионных пар более подробно будет рассмотрено ниже. [2]
Образование ионных пар, естественно, зависит от прочности связи металл - углерод. Уменьшение / - характера этой связи способствует диссоциации на свободные ионы. Полимеризация изопрена на металлич. [3]
Образование ионных пар снижает концентрацию свободных ионов в растворе и вследствие этого уменьшает электропроводность раствора. Следует заметить, что образование ионной пары не равносильно образованию из ионов недиссоциированных молекул или комплексных соединений. В отличие от последних, ионы в ионной паре связаны только электростатическими, а не химическими силами. [4]
Образование ионных пар в системе, состоящей из двух электродов, между которыми существует разность напряжений, приводит к уменьшению наложенного потенциала в соответствии с известными законами электростатики. [5]
Образование ионных пар, естественно, зависит от прочности связи металл - углерод. Уменьшение р-характера этой связи способствует диссоциации на свободные ионы. Полимеризация изопрена на металлич. [6]
Образование ионных пар между анион-радикалом ароматических нитросоединений и катионом фона облегчает присоединение последующих электронов к анион-радикалам [31], о чем подробнее речь будет идти в разделе, посвященном ЕСЕ-процессам. [7]
Образование ионных пар может коренным образом изменить характер происходящих в растворе электронных переходов. [8]
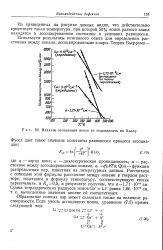 |
Влияние ассоциации ионов на подвижность по Холлу. [9] |
Образование ионных пар может сказаться также на величине растворимости. [10]
Образование ионных пар или молекул в растворах электролитов проявляется по крайней мере двояким образом: частично уменьшается активность ионов и меняется градиент свободной энтальпии; частично уменьшается сопротивление трения ионов в связи с образованием одной большой частицы из нескольких меньших. Если изменение свободной энтальпии учитывается в зависимости коэффициента активности от концентрации, установленной в данном растворе экспериментально ( как это было сделано в предыдущих разделах), ассоциация уже не изменяет этот фактор. [11]
Образование ионных пар или молекул изменяет также и электрофоретический эффект, так как ионная концентрация в растворах бинарных электролитов уменьшается от сса до асса, если а - степень диссоциации электролита. [12]
Образование ионных пар имеет большое значение в аналитиче ской химии неводных растворов ( см. гл. [13]
Образование ионных пар возможно в том случае, если электростатические взаимодействие между ионами больше, чем их средняя кинетическая энергия. Незаряженные ионные двойники отличаются от обычных диссоциированных мо. Обычно принимается, что распад и образование ионных пар не требует н отличие от обычных молекул никакой энергии активации. Такое заключение вряд ли можно принять безоговорочно, так как эти процессы сопровождаются изменениями сольиатпых оболочек, что связано со значительными энергетическими эффектами. [14]
Образование ионных пар является характерным свойством неводных растворов электролитов. Но следует иметь в виду, что ионные пары образуются также и в водных растворах некоторых электролитов ( например, KNO3), хотя в значительно меньшей степени. [15]
Страницы: 1 2 3 4