Образование - ионные пары
Cтраница 3
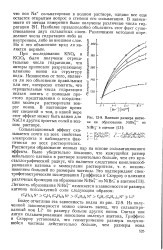 |
Влияние размера катио-на на образование - NiBr из № ВгГ в ацетоне. [31] |
Рассмотрим образование ионных пар на основе сольватационного эффекта. [32]
Помимо образования ионных пар большое значение имеют и другие типы реакций ассоциации, происходящие в неводных растворителях. Часто анион А -, возникающий из кислоты НА, сольватирован лишь в небольшой степени; тогда его стабилизация происходит за счет взаимодействия со второй молекулой кислоты ( гомосопряжение), что приводит к образованию НАз - Явление гомосопряжения может быть изучено с помощью таких методов, как спектроскопия и кон-дуктометрия. [33]
Реальность образования ионных пар была надежно установлена методом ЭПР, когда удалось обнаружить сверхтонкое расщепление на ядрах щелочного катиона в солях ароматических анион-радикалов. Первое такое наблюдение было сделано в работе Атертона и Вайсмана [27] для нафталиннатрия в тетрагидрофуране. Константы сверхтонкого взаимодействия с натрием сильно зависят от температуры и растворителя. [34]
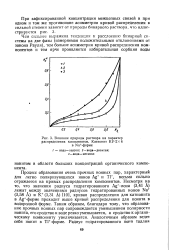 |
Влияние природы раствора на характер. [35] |
Процесс образования очень прочных ионных пар, характерный для легко поляризующихся ионов Ag и Т1, весьма сильно отражается на кривых распределения компонентов. Несмотря на то, что значения радиуса гидратированного Ag - Hona ( 3 41 А) лежат между значениями радиусов гидратированных ионов Na ( 3 58 А) и К ( 3 31 А) [10], кривая распределения для катионита в А § - форме проходит выше кривой распределения для ионита в водородной форме. Таким образом, благодаря тому, что образование прочных ионных пар сопровождается уменьшением полярности ионита, его сродство к воде резко уменьшается, а сродство к органическому компоненту увеличивается. Аналогичным образом ведет себя ионит в Т1 - форме. [36]
Пренебрегая образованием ионных пар, найдите интервал изменения рН при переходе от 10 - 3 F раствора сильной кислоты к 10 - 3 F раствору сильного основания в ледяной уксусной кислоте, константа автопротолиза которой ( p / ts 14 45) сравнима с константой воды. [37]
Если образованием ионных пар можно пренебречь, как это обычно делают в случае водных растворов, то появляется простой способ для распознания последовательного и согласованного механизмов. [38]
Следовательно, образование ионных пар сопровождается частичной десольвата-цией ионов, а кулоновское взаимодействие дополняется некулоновским. Образование ионных пар следует рассматривать как процесс образования ионных сольватированных молекул, а процесс диссоциации сильных электролитов в принципе не отличается от любого процесса диссоциации. С другой стороны, многие данные указывают, что соли, как и кислоты и основания, наряду с сольватированными ионными парами образуют в растворе неионизированные продукты присоединения. Об этом свидетельствуют и многочисленные данные физико-химического анализа и термодинамические исследования свойств растворов. [39]
Комплексообразование и образование ионных пар - обычные явления в химии растворов. Поэтому при предсказании условий осаждения необходимо в первую очередь всегда рассматривать все возможные равновесия в растворе и затем исключать из рассмотрения те из них, которые по расчету меньше всего влияют на весь рассматриваемый процесс в целом. [40]
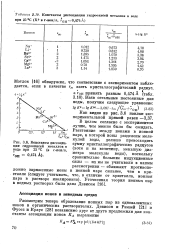 |
Константы диссоциации гидроокисей металлов в воде при 25 SC ( К в г-ион / л, гон 0 474А.| Константы диссоциации гидроокисей металлов в воде при 25 РС ( в г-ион / л. [41] |
Рассмотрим теперь образование ионных пар из одновалентных ионов в органических растворителях. [42]
Поскольку на образование ионных пар влияют все свойства растворов, многие из них - активности, электропроводность, числа переноса, поглощение света, оптическое вращение - скорости реакций, коэффициент распределения и ионообменное равновесие - используются для исследования этого явления. В неводных растворах образование ионных пар - обычное явление и проявляется сильнее, чем в воде, отчасти вследствие более низкой диэлектрической проницаемости и более сильных электростатических взаимодействий. [43]
Так как образование ионных пар тем вероятнее, чем меньше размеры катиона и аниона, реакционная способность уменьшается в наибольшей степени именно для солей с малыми анионами. [44]
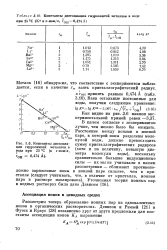 |
Константы диссоциации гидроокисей металлов в воде при 25 - С ( К в г-ион / л, гон 0 474А.| Константы диссоциации гидроокисей металлов в воде при 25 РС ( в г-ион / л. [45] |
Страницы: 1 2 3 4