Образование - ароматическая система
Cтраница 1
Образование ароматических систем и циклизация алкенов происходит и при использовании алюмомолибденового катализатора. [1]
Энергия образования ароматической системы пиридина составляет примерно 134 кДж / моль ( ср. [2]
В некоторых случаях образование замкнутой ароматической системы электронов возможно даже тогда, когда цепь сопряженных л-связей разорвана включением в нее насыщенного фрагмента. Если, тем не менее, за счет благоприятного геометрического строения цикла отдельные л-орбитали сближены в пространстве, они могут эффективно перекрываться, и это приводит к образованию делокализованных систем, называемых го. [3]
Энергетический выигрыш при образовании ароматической системы обусловливает повышенную устойчивость бензола по сравнению с элкенэми и сопряженным. [4]
Энергетический выигрыш при образовании ароматической системы обусловливает повышенную устойчивость бензола по сравнению с алкенами и сопряженными нециклическими полие-нами к реакции присоединения по кратным связям, поскольку при этом должна нарушиться ароматическая система. [5]
В обоих случаях превращение сопровождается образованием более насыщенной ароматической системы. [6]
Перинафтенон XXXIX обнаруживает заметную тенденцию к образованию альтернантных ароматических систем. [7]
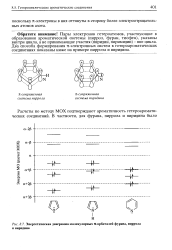 |
Энергетическая диаграмма молекулярных Jt-орбиталей фурана, пиррола и пиридина. [8] |
Пары электронов гетероатомов, участвующие в образовании ароматической системы ( пиррол, фуран, тиофен), указаны внутри цикла, а не принимающие участия ( пиридин, пиримидин) - вне цикла. Два способа формирования я-электронных систем в гетероароматических соединениях показаны ниже на примере пиррола и пиридина. [9]
Положительным концом диполя являются гетероатомы, передающие для образования ароматической системы по одной паре р-электронов, а отрицательным - углеводородная часть гетероцикла. Поэтому ароматическое кольцо в этих соединениях имеет большую электронную плотность, чем бензол. По реакционной способности к бензолу наиболее близок тиофен; в этом отношении его можно сравнивать с нафталином и антраценом. [10]
Положительным концом диполя являются гетероатомы, передающие для образования ароматической системы по одной паре р-электронов. Поэтому ароматическое кольцо в этих соединениях имеет большую электронную плотность, чем бензол. По реакционной способности к бензолу наиболее близок тиофен; в этом отношении его можно сравнивать с нафталином и ант-раценом. По реакционной способности пиррол ц фуран превосходят даже фенол и анилин. [11]
Благодаря тому, что р-электроны гетероатома участвуют в образовании ароматической системы, сами гетероатомы утрачивают некоторые характерные для них свойства. Пиррол ( 14; X NH) в отличие от пирролидипа ( 15; X NH) не образует с алкилга-логенидами соли четвертичных аммониевых оснований, а крайне нестойкие соли образует только с сильными кислотами Льюиса. [12]
Благодаря тому, что р-электроны гетероатома участвуют в образовании ароматической системы, сами гетероатомы утрачивают некоторые характерные для них свойства. [13]
В этой главе рассматриваются некоторые реакции, приводящие к образованию ароматических систем в результате восстановления, а также реакции тропоноидных систем с комплексными гидридами металлов. [14]
 |
Четыре варианта плоскостного расположения шести. [15] |
Страницы: 1 2 3 4