Образование - циклобутан
Cтраница 3
 |
Геометрия сближения молекул бутадиена и этилена при реакции Дильса - Альдера. [31] |
Рассмотрим в простейшем варианте реакцию Дильса - Альдера на примере взаимодействия s - цис-бутадиена с этиленом, приводящую к цик-логексену; и обратный процесс распада циклогексена до этилена и бутадиена. Как и рассмотренное выше образование циклобутана из этилена - это синхронная1 реакция циклоприсоединения. [32]
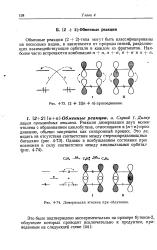 |
Димеризация этилена при облучении. [33] |
Реакция димеризации двух молекл этилена с образованием циклобутана, относящаяся к [ п я ] - присс динению, обычно запрещена как синхронный процесс. [34]
Указывалось, что конденсация этилена с образованием циклобутана запрещена и что симметричные заместители могут понижать энергии активации за счет конфигурационного взаимодействия. Возьмем две молекулы пропилена, которые могут циклизоваться по типу голова к голове или голова к хвосту. [35]
Пинан можно окислять кислородом воздуха до гидроперекиси - пинана. При 110 С эта гидроперекись разлагается с образованием производного циклобутана, которое дает качественную реакцию с йодоформом, указывающую, что это - метилкетон. [36]
Присоединение карбенов к олефинам с образованием циклопропанов ( 2 13) разрешено термически, если в переходном состоянии происходит перекрывание я-орбиталей олефина и вакантной орбитали синглетиого карбена, так называемый нелинейный хелетропный процесс. Термическое присоединение двух олефинов друг к другу с образованием циклобутанов с участием четырех электронов обычно не проходит ( если такая реакция имеет место, то, вероятно, осуществляется постадийный процесс, к которому не применимы правила синхронного присоединения), однако хорошо известно фотохимическое присоединение этого типа. Имеется мало простых примеров присоединения аллильных анионов к олефинам ( уравнение 153; 4д 2, где д), однако, как показано ниже, этой схеме отвечает ряд реакций образования гетероциклов, разрешенных термически. Обе эти реакции разрешены термически, и в них принимают участие шесть электронов. [37]
Эта константа несколько превышает соответствующие экспериментальные величины для димеризации тетрафторэтилена и хлортрифторэтилена, но энергия активации процесса значительно больше. Последнее различие, вероятно, объясняет то, что образование циклобутана при димеризации этилена до настоящего времени не наблюдалось. [38]
Определения энергий активации прямых и обратных процессов показали, что энтальпия образования окта-фторциклобутана из двух молекул тетрафторэтилена равняется - 50 кк. Эта величина значительно больше, чем величина - 25 ккал, которая, как полагают [44], отвечает образованию циклобутана из двух молекул этилена, и она показывает, что в тетрафторэтилене имеется слабая двойная связь и ( или) имеется благоприятное расположение атомов фтора и прочные одинарные связи в октафторциклобутане. [39]
С точки зрения синтеза образование циклобутана является очень важной фотохимической реакцией. Хотя такие реакции и многочисленны, они, к сожалению, не имеют общего характера, и во многих случаях не выяснены даже факторы, влияющие на образование циклобутана. [40]
Фотоциклоприсоединение пя - возбужденного енона к олефи-нам, обогащенным электронами, может представлять собой случай, для которого применимы концепции разд. В частности, эти фотореакции могут включать двухканальный механизм пя - состояния, где путь низшей энергии ведет к неэффективному ( 2Я5 2Яз) - Циклоприсоединению и потере энергии через возбужденный интермедиат, в то время как высокоэнергетический путь ведет к ( 2Я3 2Яа) - образованию циклобутана и оксетана. [41]
В каждой паре взаимодействующие орбитали соответствуют друг другу. Теперь синхронная реакция образования циклобутана разрешена по симметрии. Реакция образования циклобутана из двух молекул этилена идет только при фотохимической активации. Рассмотрим в качестве примера еще реакцию взаимодействия На и Ь в газовой фазе. Расчет по суммам состояния показал, что предэкспоненциальный множитель существенно отличается от опытных значений. [42]
В каждой паре взаимодействующие орбитали соответствуют друг другу. Теперь синхронная реакция образования циклобутана разрешена по симметрии. Реакция образования циклобутана из двух молекул этилена идет только при фотохимической активации. Рассмотрим в качестве примера еще реакцию взаимодействия Hz и Ь в газовой фазе. Расчет по суммам состояния показал, что предэкспоненциальный множитель существенно отличается от опытных значений. [43]
СзСзрЧз) 2 - 0, так как значения постоянных ( без учета знака) в молекулах А и В будут одинаковы. Кулоновское взаимодействие может вызывать только отталкивание, так как атомы 1 и 4 и 2 и 3 несут одинаковые заряды. Таким образом, реакция образования циклобутана из двух молекул этилена, находящихся в их основном энергетическом состоянии, протекать не может, так как взаимодействующие атомные орбитали в ВЗМО молекулы Айв НСМО молекулы В не соответствуют друг другу; принято говорить, что реакция запрещена по симметрии. [44]
Вероятностный аспект эффективной встречи двух реакционных центров внутри одной молекулы рассмотрен здесь крайне упрощенно. В действительности дело определяется ие только расстоянием между этими центрами по прямой, но и взаимной ориентацией этих групп. Для учета этих факторов необходимо включить в рассмотрение вращательные стопснп свободы ( поворот групп С и С1 вокруг связей С 1 - С и С1 - С, а также поворот вокруг центральной связи С-С при образовании циклобутанов), однако такой более строгий анализ не изменяет качественно выводов, приведенных в тексте. [45]
Страницы: 1 2 3 4