Образование - я-связь
Cтраница 4
 |
Стереохимия соединений S, Se, Те. [46] |
В молекуле SO2 два электрона атома серы способны участвовать в образовании я-связей. Один из этих электронов находится на 3pz - и другой на cfn - орбитали-их взаимодействие с 2р2 - орбиталями кислорода ( на каждой и которых находится по одному электрону) приводит к возникновению обычных двойных связей. Это согласуется со строением молекулы, так как экспериментально определенное значение угла OSO равно 119 5, а длина связи S-О - 143 пм. [47]
На рис. 29 показано пространственное расположение орбиталей по Кос-си при образовании я-связи ( такой тип связи впервые обсуждался Чаттом ИЗО ]) между переходным металлом и простейшим олефином - этиленом. Следует обратить внимание, что, согласно приведенной схеме, молекула олефина располагается перпендикулярно направлению свободных валентностей иона металла. Jxy-орбиталь металла может перекрываться с разрыхляющей орбиталью олефина. Образно говоря, между металлом и олефином образуется своего рода двойная связь, в которой одна из компонент связи имеет сг -, а другая - я-тип симметрии. [48]
Этот механизм отвечает мономолекулярной реакции отщепления функциональной группы и также сопровождается образованием я-связи. Реакция проходит в две стадии. [49]
Если верно предположение Джаффе [151] и Крейга [152] о том, что образование я-связи с атомом, имеющим вакантные d - орбитали, более эффективно, когда этот атом несет положительный заряд, то можно сделать вывод, что более низкая электронная плотность на фосфоре наблюдается в случае трифенильного илида. На первый взгляд это выглядит удивительным, поскольку обычно фенильные группы более сильные доноры электронов, чем алкильные. Однако известны случаи, когда фенильная группа оказывает сильное электроноакцептор-ное действие. Например, Уэпстер [153] показал, что в анилине электроноакцепторность фенила слагается как из резонансного, так и индуктивного эффектов, причем вклад последнего составляет примерно половину общего эффекта. Когда фенильное кольцо включается в бициклическую систему хинуклидина, геометрия молекулы исключает существенное резонансное взаимодействие между атомом азота и фенильным кольцом. Остается только индуктивный эффект фенильного кольца, который оказывается сильно отрицательным. [50]
Более детальный анализ покажет, что простая диаграмма молекулярных орбиталей преувеличивает степень образования я-связи, но она подтверждает и существование некоторой делокализации я-электронов в сопряженных двойных связях. [51]
Рассмотрим октаэдрический комплекс переходного металла, ли-ганды которого не проявляют склонности к образованию я-связей. Из шести АО лигандов и девяти АО комплексообразователя возникают 15 МО. Для образования а-связей пригодны шесть орбиталей: dz, dx - y i s, px, py, pz, так как ветви их лежат вдоль прямых, соединяющих атомы металла и лиганда. Остальные три орбитали ( dxy, dxz, dyz) являются несвязывающими, так как их электронные облака направлены между лигандами, и энергия этих орбиталей практически не меняется. [52]
Лиганды без неподеленных пар электронов, но с электронами, участвующими в образовании я-связи, например этилен, алкены, бензол, циклопентадиенил-ион. [53]
 |
Стереохимия непереходных элементов ( кратные связи. [54] |
Возможно, что атомные d - орбитали вследствие большей направленности перекроются при образовании я-связи в большей степени, чем атомные s - или р-орбитали, и поэтому всегда ( когда возможно) d - орбитали используются предпочтительно для таких связей. [55]
Вследствие этого они способны отдавать отрицательный заряд атому металла, в результате происходит образование я-связи, характерной для ненасыщенного лиганда. [56]
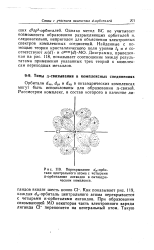 |
Перекрывание я-орби. [57] |
Орбитали dxz, dyz и dxy в октаэдрических комплексах могут быть использованы для образования я-связей. [58]
Таким образом, эти данные еце раз указывают на особую склонность NO к образованию я-связи с рутением. [59]
В лаборатории автора было обнаружено, что содержащие координированные восстановители, способные к образованию я-связей, комплексные ионы [ Pt ( N03) 4 ] 2 - и особенно [ Pt ( CN) J2 - лишь с трудом могут быть окисляемы в условиях, в которых ионы [ Pt ( NH3) 4 ] 2 или [ PtQ4 ] 2 - окисляются с легкостью. Как показали опыты И. И. Черняева и Назаровой4в, трудная окисляемость K2 [ Pt ( N02) 4 ] перманганатом калия в нейтральной среде не исключает возможности синтеза ранее не известного гексанитроплатеата калия K2 [ Pt ( N02) 6 ] при правильно выбранных условиях эксперимента. [60]
Страницы: 1 2 3 4