Поверхностный окисел
Cтраница 1
Поверхностный окисел В в водном растворе образует гидроксильные группы, обмен которых на анионы сильных кислот или солей обусловливает адсорбцию кислот из водных растворов и гидролитическую адсорбцию солей. [1]
Поверхностный окисел В имеет также основной характер и образуется из окисла А при давлении кислорода, превышающем 2 мм рт. ст. Он стабилен при низких температурах до давления 40 ат. Уголь, активированный при 900 в обычных условиях, покрыт этим окислом. [2]
Поверхностный окисел В имеет также основной характер и образуется из окисла А при давлении кислорода, превышающем 2 мм рт. ст. Он стабилен при низких температурах до давления 40 ст. Уголь, активированный при 900 в обычных условиях, покрыт этим окислом. [3]
Поверхностный окисел существенно отличается от основного металла, и его структура подлежит дальнейшему уточнению. Однако ионы металла и кислорода на поверхности тесно взаимосвязаны и, возможно, расположены вперемешку в одной и той же плоскости. При этом поверхностный окисел экранирует металл от других скачков потенциала, кроме барьерного. [4]
Когда поверхностный окисел металла нелетуч, некоторые сведения о нем можно получить с помощью метода дифракции электронов. [5]
МО - поверхностный окисел; является вторая стадия. [6]
В этих экспериментах поверхностный окисел не удалось обнаружить с помощью использовавшегося эллипсометра при потенциале ниже 0 95 В [102]; г - потенциодинамические данные и результаты эксперимента с быстрым следящим эллипсометром Грифа [103] для поверхностного окисла платины: А - циклическая потен-циограмма в 0 5 М водном растворе H2S04, 0 1 цикла в секунду; Б - соответствующий заряд в мкКл ( как функция потенциала) графики для Д и ч получены в четырех последовательных развертках. [7]
На вольфраме образуется поверхностный окисел WO, энергия активации реакции Е - 23 ккал-моль-1. Подвижные частицы, обнаруженные в электронном проекторе, по-видимому, представляют WO, а не О. Таким образом, вольфрам является активным катализатором диссоциации кислорода и ведет себя при этом так же, как в водороде. [8]
Определяющей является десорбция поверхностного окисла. [9]
Можно предположить, что поверхностный окисел является настолько тонким, что его невозможно увидеть. В результате полного закрытия металла окислом металл не может анодно растворяться, не подвергается воздействию кислот и не вытесняет других металлов из раствора. Эта теория пользовалась общим признанием до тех пор, пока Гитторф в своей работе над хромом не показал, что теория наталкивается на значительные трудности и что свойства окисла, являющегося причиной пассивности, должны были бы отличаться от свойств любых известных окислов этого металла. Далее были сделаны наблюдения, согласно которым способность к отражению света у пассивного анода и у катода, который является активным, якобы одинакова, что позволяло сделать заключение об отсутствии пленки окисла на аноде. [10]
Согласно этой схеме образование пленки поверхностного окисла препятствует дальнейшей реакции, которая может развиваться лишь по мере разложения указаного поверхностного соединения. [11]
Образующийся при температурах до 500 С поверхностный окисел состоит из порошка; при температурах выше он представляет собой уже зернистые частицы, которые при температурах выше 880 С становятся тверже и плотным слоем закрывают металл. Неизвестно, диффузией каких частиц определяется скорость окисления урана при температурах выше 880 С, но Гопкинсон утверждает, что переход при этих температурах от параболического окисления к линейному можно объяснить существованием барьерного слоя постоянной толщины. При температурах выше температуры плавления уран окисляется с меньшей скоростью, чем при - 750 С, когда на кривой окисления возникает второй максимум скорости. [12]
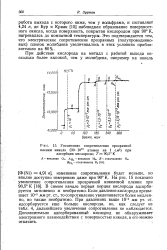 |
Увеличение сопротивления прозрачной. [13] |
Бур и Краак [15] наблюдали образование поверхностного окисла, когда поверхность, покрытая кислородом при 90 К, нагревалась до комнатной температуры. [14]
Из опытов следует вывод, что образуется устойчивый поверхностный окисел и нарастание его идет параллельно и одновременно с образованием газообразного продукта - СО. Таким образом, получился неожиданный результат: образование поверхностного окисла является отдельной реакцией, протекающей одновременно и параллельно, а не последовательно ( консекутивно) с газообразованием. [15]
Страницы: 1 2 3 4