Поверхностный окисел
Cтраница 4
Согласно [19], вполне возможным является полное преобразование наружной углеродной сетки графитного кристаллика в окисленные производные ( так называемый поверхностный окисел) раньше, чем наступает заметное разрушение графита из-за образования газообразных продуктов окисления. При использовании кислорода, обогащенного озоном, удается напитать графит кислородом до такой степени, что последний составляет до 40 % От всего продукта. Рентгенографические исследования такого продукта приводят к выводу, что если адсорбция кислорода происходит с одной стороны гексагональной сетки, то образуется устойчивый поверхностный окисел в виде твердого соединения. В соответствии с этим углеродные комплексы в жидком чугуне при температурах несколько выше ликвидуса можно представить в виде пакетов гексагональных сеток, частично или полностью окруженных кислородными оболочками. [46]
В 1956 г. Розенталь и Веселовский [225] использовали изотоп 18О в качестве индикатора, чтобы определить, участвует ли поверхностный окисел на платине в выделении кислорода. [47]
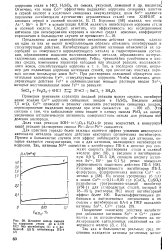 |
Влияние иоиов никеля на коррозию стали 40 в 3 7М НС1 без ингибитора ( / и с добавкой 0 5 % ингибитора ПБ-4 ( 2. [48] |
Эта связано с тем, что кобальтовые ионы входят в пленку окисла РЬО2 на аноде, увеличивая каталитическую активность поверхностного окисла для реакции выделения кислорода. [49]
Возможно, что после разрыва молекул кислоты на ионы ОН - и NO з из последних ионов и молекул поверхностного окисла сразу образуются ионы Fe и NO -, и первые из них пере-содят в глубь раствора, а вторые входят во внешнюю обладку двойного электрического слоя. [50]
По количеству кислорода мономолекулярный слой его плотно упакованных адсорбированных атомов или молекул эквивалентен двум-четырем молекулярным слоям, составленным из поверхностного окисла. [51]
Наконец, наша неспособность выразить свойства поверхности через свойства объемных окислов убедительно показана данными, свидетельствующими о большей стабильности пленки поверхностного окисла на серебре, чем на палладии. Это противоречит известным свойствам соответствующих объемных фаз. [52]
Рассмотрим теперь следующие процессы, которые происходят на поверхности: 1) образуется поверхностный окисел типа 1; 2) образуется поверхностный окисел типа 2; 3) поверхностный окисел типа 1 покидает поверхность; 4) поверхностный окисел типа 2 покидает поверхность; 5) свободные места типа 1 превращаются в места типа 2 с константой скорости первого порядка k3; 6) поверхностный окисел типа 1 становится на место окисла типа 2; константа скорости для этого процесса первого порядка k4; 7) места типа 2 превращаются в места типа 1 со скоростью, которая пропорциональна числу мест типа 2 и скорости, с которой окисел типа 1 покидает поверхность. Скорость этого процесса дается выражением ( I / a) k - ( 1 - f) N, где 1 / а - коэффициент пропорциональности. Возможность процесса 7 будет показана, когда будет обсуждаться физическая интерпретация кинетики. [53]
С позиций стадийности окислительно - восстановительного катализа в рабо - та Г.К. Борескова и его сотрудников последовательно развивалась концепция об энергии связи кислорода поверхностного окисла как факторе, существенно опре - де. Ими установлено, что каталитическая активность возрастает с понижением энергии связи кислорода, которая зависит от легкости изменения валентного состояния ка гиона металла в окисле, обусловливаемой его электронной структурой. Эти данные свидетельствуют о том, что лимитирующим этапом в окислительно - восстанови - тельных реакциях является отрыв кислорода с поверхности катализатора. Не случайно, что катализаторы на их основе находят весьма широкое применение в нефтепереработке и нефтехимии. [54]
Небольшое расхождение с экспериментальным уравнением в коэффициентах, стоящих перед 1п [ ОН - ], объясняется проще всего некоторым изменением каталитических свойств поверхностного окисла при изменении концентрации щелочи. Отметим, что анодное выделение кислорода на двуокиси свинца в серной кислоте [12,13] также связано с промежуточным образованием радикала гидроксила ОН. [55]
Страницы: 1 2 3 4